よむ、つかう、まなぶ。
別紙1○患者申出療養に係る新規技術の科学的評価等について (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
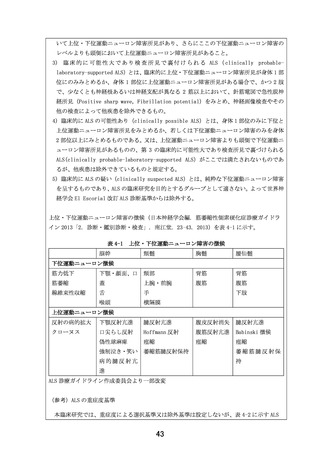
た日数が 30 日よりも長い場合は、半減期の 5 倍の日数が経過している必要有)又は同意取得
時に医師主導治験(DA350103)以外の臨床試験に参加又は参加を予定している患者
13)同意取得前に細胞治療、又は遺伝子治療を受けた患者
14)研究責任医師又は研究分担医師が本臨床研究への参加を不適当と判断した患者
【除外基準設定の根拠】
1)
安全性を適切に評価するため設定した。
2)
有効性及び安全性を適切に評価するため設定した。
3)
呼吸機能が低下している患者を除外するため設定した。
4)
1 日 3 回の EPI-589 の継続的な内服が困難である可能性があるために設定した。
5)
安全性を配慮し、設定した。
6)
安全性を適切に評価するため設定した。
7)
肝機能障害を伴った患者が EPI-589 を服用した際の安全性が未確立であるため、設定した。
8)
サルの 39 週間経口投与毒性試験(1660-080 試験)で EPI-589 500 mg/kg/日(最小毒性量)投
与時に用量制限毒性(DLT)として筋線維変性が認められたため、臨床でモニタリングする必
要がある。またサルを用いた非臨床試験(JB18356 試験)でバイオマーカーの探索を実施した
ところ、CK が筋線維変性のモニタリングが可能な臨床バイオマーカーであることが示唆され
た。本除外基準は、上記結果に基づき、筋線維変性のバイオマーカーである CK を適切にモニ
タリングするため設定した。
9)
腎機能障害を伴った患者が EPI-589 を服用した際の安全性が未確立であるため、設定した。
10) 本被験薬の妊娠又は授乳中の投与に関する安全性について明確な見解が得られていないため、
安全性を考慮し、設定した。
11) 本被験薬の妊娠又は授乳中の投与に関する安全性について明確な見解が得られていないため、
安全性を考慮し、設定した。
12) 有効性及び安全性を適切に評価するため設定した。
13) 有効性及び安全性を適切に評価するため設定した。
14) 安全性を配慮し、設定した。
(参考)診断基準
El Escorial 改訂 Airlie House 診断基準(Brooks, BR .et al. Amyotroph Lateral Scler Other
Motor Neuron Disord. 1: 293-9. 2000)おいて、definite、probable、probable-laboratory supported
ALS に該当する孤発性 ALS と診断された患者を本臨床研究の対象症例とする。診断基準は以下に示
す。
1) 臨床的に確実な ALS(clinically definite ALS)とは、身体 3 部位において上位運動ニュー
ロンと下位運動ニューロン障害の臨床所見があること。
23
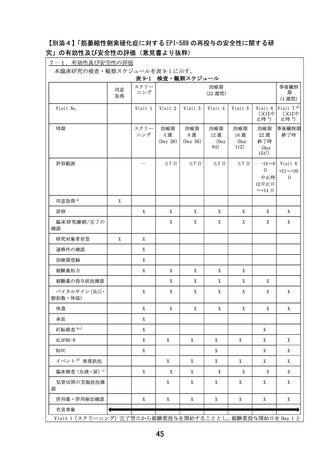
時に医師主導治験(DA350103)以外の臨床試験に参加又は参加を予定している患者
13)同意取得前に細胞治療、又は遺伝子治療を受けた患者
14)研究責任医師又は研究分担医師が本臨床研究への参加を不適当と判断した患者
【除外基準設定の根拠】
1)
安全性を適切に評価するため設定した。
2)
有効性及び安全性を適切に評価するため設定した。
3)
呼吸機能が低下している患者を除外するため設定した。
4)
1 日 3 回の EPI-589 の継続的な内服が困難である可能性があるために設定した。
5)
安全性を配慮し、設定した。
6)
安全性を適切に評価するため設定した。
7)
肝機能障害を伴った患者が EPI-589 を服用した際の安全性が未確立であるため、設定した。
8)
サルの 39 週間経口投与毒性試験(1660-080 試験)で EPI-589 500 mg/kg/日(最小毒性量)投
与時に用量制限毒性(DLT)として筋線維変性が認められたため、臨床でモニタリングする必
要がある。またサルを用いた非臨床試験(JB18356 試験)でバイオマーカーの探索を実施した
ところ、CK が筋線維変性のモニタリングが可能な臨床バイオマーカーであることが示唆され
た。本除外基準は、上記結果に基づき、筋線維変性のバイオマーカーである CK を適切にモニ
タリングするため設定した。
9)
腎機能障害を伴った患者が EPI-589 を服用した際の安全性が未確立であるため、設定した。
10) 本被験薬の妊娠又は授乳中の投与に関する安全性について明確な見解が得られていないため、
安全性を考慮し、設定した。
11) 本被験薬の妊娠又は授乳中の投与に関する安全性について明確な見解が得られていないため、
安全性を考慮し、設定した。
12) 有効性及び安全性を適切に評価するため設定した。
13) 有効性及び安全性を適切に評価するため設定した。
14) 安全性を配慮し、設定した。
(参考)診断基準
El Escorial 改訂 Airlie House 診断基準(Brooks, BR .et al. Amyotroph Lateral Scler Other
Motor Neuron Disord. 1: 293-9. 2000)おいて、definite、probable、probable-laboratory supported
ALS に該当する孤発性 ALS と診断された患者を本臨床研究の対象症例とする。診断基準は以下に示
す。
1) 臨床的に確実な ALS(clinically definite ALS)とは、身体 3 部位において上位運動ニュー
ロンと下位運動ニューロン障害の臨床所見があること。
23