よむ、つかう、まなぶ。
別紙1○患者申出療養に係る新規技術の科学的評価等について (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
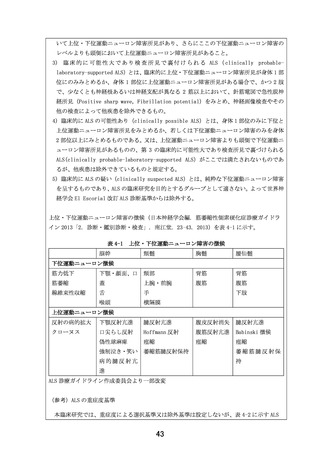
5.「患者申出療養の内容 (概要)」について。申出に係る療養の名称は「筋萎縮性側索硬化症に対
する EPI-589 の再投与の安全性に関する研究」とされているが、患者申出療養の内容 における(概
要)と(効果)は上記の「EPI-589 の再投与の安全性に関する研究」に関する記述が基本になるので
はないでしょうか。申出に係る療養の名称と,概要,効果の記述に一貫性があることが求められるの
ではないでしょうか。「【主要評価項目】有害事象、【副次評価項目】ALSFRS-R スコア変化量及び変
化率など」に対応した記述が必要なのだと思います.主要評価項目について、まず記述するべきで
はないか。
【回答】
ご指摘の通り、様式第 5 号「患者申出療養の内容 (概要)」は本研究の内容と齟齬があります。ご指
摘に従い、記載整備の上、下記の通り修正いたしました。
(修正前)
筋萎縮性側索硬化症は未だ治療法が確立されていない難治性神経変性疾患で、現状承認されている
薬剤はわずか 2 種類でより生存期間を延長する、または臨床症状を改善する、または使いやすい薬剤
の開発が期待されている。本研究は、患者申出療養制度に基づいて、先行する医師主導治験
(DA350103)において一定の効果が期待される EPI-589 を筋萎縮性側索硬化症患者を対象とした前向
き介入試験である。
(修正後)
筋萎縮性側索硬化症(ALS)は未だ治療法が確立されていない難治性神経変性疾患で、現状承認され
ている薬剤はわずか 2 種類でより生存期間を延長する、または臨床症状を改善する、または使いやす
い薬剤の開発が期待されている。本研究は、患者申出療養制度に基づいて、先行する医師主導治験
(DA350103)において使用された ALS に対して一定の効果が期待される EPI-589 を、DA350103 に参加
した ALS 患者に対して再投与した際の安全性と忍容性を確認する前向き介入試験である。
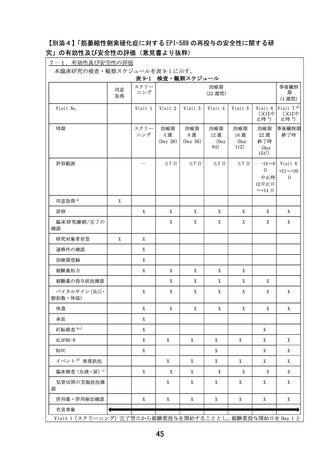
6.研究計画書10.1 有効性評価項目及び評価方法について研究責任医師又は分担医師が担当
するとありますが、独立な第3者による評価は行われないのでしょうか? 行われない場合、結果の
妥当性をどう担保するか記載してください。先行の医師主導治験では独立な第3者による判定が行
われているのでしょうか? 可能な限り同様のスキームで行うべきと考えます。
【回答】
先行の医師主導治験と同様に、本治験での有効性評価項目(ALSFRS-R、%SVC、イベント)及び評
価方法は、研究責任医師又は分担医師が担当します。
ALSFRS-R は、ALS 患者の経過を客観的かつ定量的に評価するために作成された臨床評価尺度で
す。 FDA から発行されている ALS 治療薬開発のガイダンス
(https://www.fda.gov/media/130964/download <https://www.fda.gov/media/130964/download>)でも、
ALSFRS-R での有効性評価が推奨されており、ALS 治療薬の開発、評価において ALSFRS-R を評価
指標として用いることは一般的と言えます。ALS を対象とした最近の臨床試験では、主要評価項目とし
て ALSFRS-R が頻用されていますが、当該評価を独立な第 3 者が行った事例は知る限りでは無く、既
承認の ALS 治療薬の臨床試験においても非盲検の試験を含めて独立な第 3 者による評価は行われて
おりません。
14
する EPI-589 の再投与の安全性に関する研究」とされているが、患者申出療養の内容 における(概
要)と(効果)は上記の「EPI-589 の再投与の安全性に関する研究」に関する記述が基本になるので
はないでしょうか。申出に係る療養の名称と,概要,効果の記述に一貫性があることが求められるの
ではないでしょうか。「【主要評価項目】有害事象、【副次評価項目】ALSFRS-R スコア変化量及び変
化率など」に対応した記述が必要なのだと思います.主要評価項目について、まず記述するべきで
はないか。
【回答】
ご指摘の通り、様式第 5 号「患者申出療養の内容 (概要)」は本研究の内容と齟齬があります。ご指
摘に従い、記載整備の上、下記の通り修正いたしました。
(修正前)
筋萎縮性側索硬化症は未だ治療法が確立されていない難治性神経変性疾患で、現状承認されている
薬剤はわずか 2 種類でより生存期間を延長する、または臨床症状を改善する、または使いやすい薬剤
の開発が期待されている。本研究は、患者申出療養制度に基づいて、先行する医師主導治験
(DA350103)において一定の効果が期待される EPI-589 を筋萎縮性側索硬化症患者を対象とした前向
き介入試験である。
(修正後)
筋萎縮性側索硬化症(ALS)は未だ治療法が確立されていない難治性神経変性疾患で、現状承認され
ている薬剤はわずか 2 種類でより生存期間を延長する、または臨床症状を改善する、または使いやす
い薬剤の開発が期待されている。本研究は、患者申出療養制度に基づいて、先行する医師主導治験
(DA350103)において使用された ALS に対して一定の効果が期待される EPI-589 を、DA350103 に参加
した ALS 患者に対して再投与した際の安全性と忍容性を確認する前向き介入試験である。
6.研究計画書10.1 有効性評価項目及び評価方法について研究責任医師又は分担医師が担当
するとありますが、独立な第3者による評価は行われないのでしょうか? 行われない場合、結果の
妥当性をどう担保するか記載してください。先行の医師主導治験では独立な第3者による判定が行
われているのでしょうか? 可能な限り同様のスキームで行うべきと考えます。
【回答】
先行の医師主導治験と同様に、本治験での有効性評価項目(ALSFRS-R、%SVC、イベント)及び評
価方法は、研究責任医師又は分担医師が担当します。
ALSFRS-R は、ALS 患者の経過を客観的かつ定量的に評価するために作成された臨床評価尺度で
す。 FDA から発行されている ALS 治療薬開発のガイダンス
(https://www.fda.gov/media/130964/download <https://www.fda.gov/media/130964/download>)でも、
ALSFRS-R での有効性評価が推奨されており、ALS 治療薬の開発、評価において ALSFRS-R を評価
指標として用いることは一般的と言えます。ALS を対象とした最近の臨床試験では、主要評価項目とし
て ALSFRS-R が頻用されていますが、当該評価を独立な第 3 者が行った事例は知る限りでは無く、既
承認の ALS 治療薬の臨床試験においても非盲検の試験を含めて独立な第 3 者による評価は行われて
おりません。
14