よむ、つかう、まなぶ。
別紙1○患者申出療養に係る新規技術の科学的評価等について (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
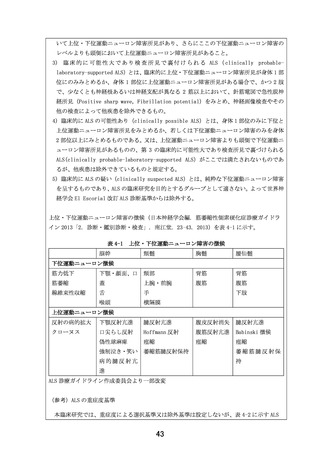
2-3.使用する医薬品、医療機器又は再生医療等製品の入手方法及び管理方法
他者からの提供の有無:
( 有 ・ 無 )
(有の場合)提供者名及び連絡先:
住友ファーマ株式会社(所在地:大阪府 大阪市中央区道修町 2-6-8)
入手及び管理方法の詳細:被験薬を取り扱う住友ファーマ株式会社(所在地:大阪府 大阪市中央区
道修町 2-6-8)から EPI-589 の無償提供を受ける。被験薬管理者は、「被験薬の管理に関する手順書」
に従い、被験薬を適切に管理するとともに、被験薬管理表を作成し、被験薬の使用状況、及び本臨床
研究の進行状況を把握する。被験薬は、室温、遮光下にて保管する。未使用被験薬、回収被験薬、使
用済みボトル、外箱は被験薬管理者が、「被験薬の管理に関する手順書」に従って適切に管理し、記
録を作成する。
3.期待される適応症、効能及び効果
適応症:
筋萎縮性側索硬化症
効能・効果:
先行する医師主導治験(DA350103)において、全被験者(いずれも EPI-589 実薬投与)での結果は現
在解析中であるが、今回本臨床研究への参加を希望している 1 名の患者での ALSFRS-R スコア(12 項
目、各項目 4 点満点の計 48 点満点、重症化に従い減点)の合計点は、平均で被験薬投与中 0 点/月、
投与終了後 1.25 点/月の減点となっている。また当院で参加したもう 1 名の経過は、被験薬投与中 1
点/月、投与終了後 2.25 点/月の減点となっている。両患者とも自覚的な日常生活動作の変化につい
ても、治験終了後に明らかにその増悪速度は速くなっていると述べている。
4.予測される安全性情報
先行する医師主導治験(DA350103)はデータ固定前であるが、10 例が治療期に移行し、全症例治験の
フォローが完了しているため、症例報告書から抽出した上記 10 例分の有害事象リスト(最終化前の
もの)を確認した。結果、重篤な有害事象、重度の有害事象の発現は認められなかった。中等度の有
害事象としては、不眠が 2 件、便秘が 2 件、頻尿が 1 件、筋痛が 1 件、関節痛が 1 件、COVID-19 感
染が 1 件認められたが、いずれも非重篤であった。
また臨床では現時点で問題となってはいないが、サル 39 週間毒性試験にて最高用量の 500mg/kg/day
群にて投与早期に活動性低下、円背姿勢、食欲不振、歯肉蒼白、体温低下、伏臥の複合した臨床症状
が認められ、原因として EPI-589 の骨格筋への影響が考えられた。
21
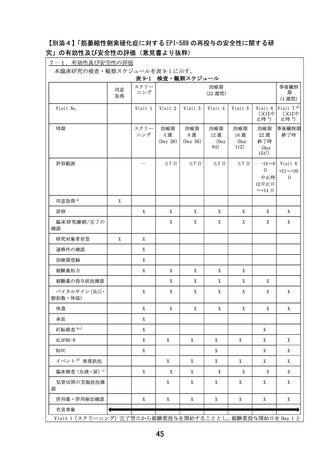
他者からの提供の有無:
( 有 ・ 無 )
(有の場合)提供者名及び連絡先:
住友ファーマ株式会社(所在地:大阪府 大阪市中央区道修町 2-6-8)
入手及び管理方法の詳細:被験薬を取り扱う住友ファーマ株式会社(所在地:大阪府 大阪市中央区
道修町 2-6-8)から EPI-589 の無償提供を受ける。被験薬管理者は、「被験薬の管理に関する手順書」
に従い、被験薬を適切に管理するとともに、被験薬管理表を作成し、被験薬の使用状況、及び本臨床
研究の進行状況を把握する。被験薬は、室温、遮光下にて保管する。未使用被験薬、回収被験薬、使
用済みボトル、外箱は被験薬管理者が、「被験薬の管理に関する手順書」に従って適切に管理し、記
録を作成する。
3.期待される適応症、効能及び効果
適応症:
筋萎縮性側索硬化症
効能・効果:
先行する医師主導治験(DA350103)において、全被験者(いずれも EPI-589 実薬投与)での結果は現
在解析中であるが、今回本臨床研究への参加を希望している 1 名の患者での ALSFRS-R スコア(12 項
目、各項目 4 点満点の計 48 点満点、重症化に従い減点)の合計点は、平均で被験薬投与中 0 点/月、
投与終了後 1.25 点/月の減点となっている。また当院で参加したもう 1 名の経過は、被験薬投与中 1
点/月、投与終了後 2.25 点/月の減点となっている。両患者とも自覚的な日常生活動作の変化につい
ても、治験終了後に明らかにその増悪速度は速くなっていると述べている。
4.予測される安全性情報
先行する医師主導治験(DA350103)はデータ固定前であるが、10 例が治療期に移行し、全症例治験の
フォローが完了しているため、症例報告書から抽出した上記 10 例分の有害事象リスト(最終化前の
もの)を確認した。結果、重篤な有害事象、重度の有害事象の発現は認められなかった。中等度の有
害事象としては、不眠が 2 件、便秘が 2 件、頻尿が 1 件、筋痛が 1 件、関節痛が 1 件、COVID-19 感
染が 1 件認められたが、いずれも非重篤であった。
また臨床では現時点で問題となってはいないが、サル 39 週間毒性試験にて最高用量の 500mg/kg/day
群にて投与早期に活動性低下、円背姿勢、食欲不振、歯肉蒼白、体温低下、伏臥の複合した臨床症状
が認められ、原因として EPI-589 の骨格筋への影響が考えられた。
21