よむ、つかう、まなぶ。
別紙1○患者申出療養に係る新規技術の科学的評価等について (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
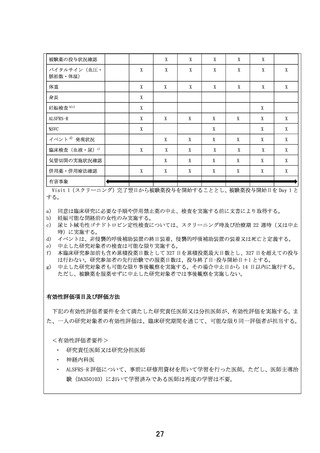
(参考)ALS の重症度基準
本臨床研究では、重症度による選択基準又は除外基準は設定しないが、表 4-2 に示す ALS の重症
度基準(森若文雄他. 運動ニューロン疾患の診断基準・病型分類・重症度. 内科. 95: 1551-1555.
2005)に基づいて、スクリーニング時点の重症度を評価し、症例報告書に記録する。なお、本臨床
研究では、介助、装具、補助具を必要とする患者であっても、日常生活、就労がほぼ独力で可能な
程度と判断された患者を、重症度 2 度に含めることとする。
表 4-2 ALS の重症度基準(厚生省特定疾患神経変性疾患調査研究班 1998 年)
重症度
1度
2度※
3度
4度
5度
基準
1つの体肢の運動障害又は球麻痺による構音障害がみられるが、日常生活、就労には
支障ない
各体肢の筋肉(4)・体幹の筋肉(1)・舌・顔面・口蓋・咽頭部(1)の6部位の筋肉
のうち、いずれか1つ又は2つの部位の明らかな運動障害のため、生活上の不自由があ
るが、日常生活、就労は独力で可能
上記6部位の筋肉のうち3以上の部位の筋力低下のために、家事や就労などの社会的生
活を継続できず、日常生活に介助を要する
呼吸、嚥下、又は坐位保持のうち、いずれかが不能となり、日常生活上すべての面で
つねに介助を要する
寝たきりで、全面的な生命維持操作が必要である
※
:本臨床研究では、介助、装具、補助具を必要とする患者であっても、日常生活、就労がほぼ独力で
可能な程度と判断された患者を含める。
6.治療計画
全例に EPI-589 を投与する(割付なし)
。
EPI-589 500 mg(EPI-589 250 mg 錠 2 錠)を 1 日 3 回食前(朝食、昼食、及び夕食のそれぞれ 1
時間以上前)に経口投与する。投与期間は、治療期登録翌日から治療期 22 週時に規定された、全て
の検査・観察の終了時までとする。
個々の研究対象者の中止
臨床研究中止基準
以下の場合、研究責任医師等は当該研究対象者の臨床研究を中止する。
1)
研究対象者より臨床研究参加継続拒否又は同意撤回の申し出があった場合
2)
有害事象の発現を認め、研究責任医師又は研究分担医師が臨床研究の継続を困難と判断した
場合
3)
研究対象者の妊娠の報告があった場合
4)
投与開始前に、研究対象者が不適格な症例であると判明した場合
25
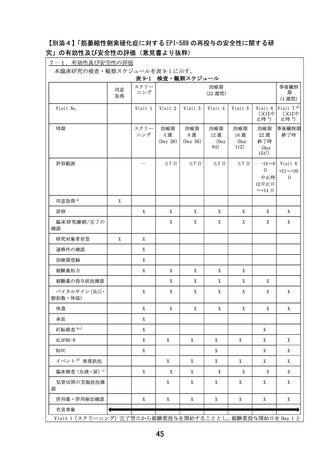
本臨床研究では、重症度による選択基準又は除外基準は設定しないが、表 4-2 に示す ALS の重症
度基準(森若文雄他. 運動ニューロン疾患の診断基準・病型分類・重症度. 内科. 95: 1551-1555.
2005)に基づいて、スクリーニング時点の重症度を評価し、症例報告書に記録する。なお、本臨床
研究では、介助、装具、補助具を必要とする患者であっても、日常生活、就労がほぼ独力で可能な
程度と判断された患者を、重症度 2 度に含めることとする。
表 4-2 ALS の重症度基準(厚生省特定疾患神経変性疾患調査研究班 1998 年)
重症度
1度
2度※
3度
4度
5度
基準
1つの体肢の運動障害又は球麻痺による構音障害がみられるが、日常生活、就労には
支障ない
各体肢の筋肉(4)・体幹の筋肉(1)・舌・顔面・口蓋・咽頭部(1)の6部位の筋肉
のうち、いずれか1つ又は2つの部位の明らかな運動障害のため、生活上の不自由があ
るが、日常生活、就労は独力で可能
上記6部位の筋肉のうち3以上の部位の筋力低下のために、家事や就労などの社会的生
活を継続できず、日常生活に介助を要する
呼吸、嚥下、又は坐位保持のうち、いずれかが不能となり、日常生活上すべての面で
つねに介助を要する
寝たきりで、全面的な生命維持操作が必要である
※
:本臨床研究では、介助、装具、補助具を必要とする患者であっても、日常生活、就労がほぼ独力で
可能な程度と判断された患者を含める。
6.治療計画
全例に EPI-589 を投与する(割付なし)
。
EPI-589 500 mg(EPI-589 250 mg 錠 2 錠)を 1 日 3 回食前(朝食、昼食、及び夕食のそれぞれ 1
時間以上前)に経口投与する。投与期間は、治療期登録翌日から治療期 22 週時に規定された、全て
の検査・観察の終了時までとする。
個々の研究対象者の中止
臨床研究中止基準
以下の場合、研究責任医師等は当該研究対象者の臨床研究を中止する。
1)
研究対象者より臨床研究参加継続拒否又は同意撤回の申し出があった場合
2)
有害事象の発現を認め、研究責任医師又は研究分担医師が臨床研究の継続を困難と判断した
場合
3)
研究対象者の妊娠の報告があった場合
4)
投与開始前に、研究対象者が不適格な症例であると判明した場合
25