よむ、つかう、まなぶ。
別紙1○患者申出療養に係る新規技術の科学的評価等について (37 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
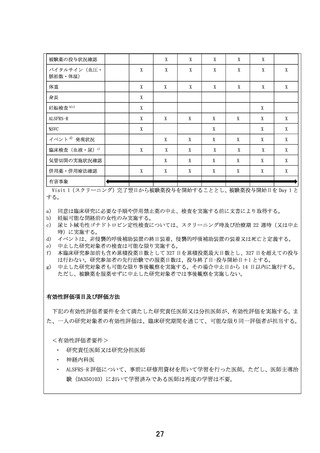
筋萎縮性側索硬化症に対するEPI-589の再投与の安全性に関する研究 (概要図)
【目的】
筋萎縮性側索硬化症患者(ALS)で、過去にEPI-589を投与された患者を対象にEPI-589を再投与したときの
安全性及び忍容性を検討する。
【対象】
筋萎縮性側索硬化症患者であって、過去に約24週間のEPI-589投与あり、かつ安全性及び忍容性に問題なく、
外来通院可能な患者
【投与方法と評価スケジュール】
EPI-589 500 mg(EPI-589 250mg錠 2錠)を1日3回食前(朝食、昼食、及び夕食のそれぞれ1時間以上前)
に経口投与する。投与期間は、治療期登録翌日から治療期22週時に規定された、全ての検査・観察の終了時ま
でとする。有害事象は同意取得から事後観察期にわたって評価され、ALFRS-Rスコアなどは治療期4、8、12、
16、22週時および事後観察期4週時に評価される。
治療期
同意取得
スクリーニング
4
8
事後観察期
12
16
22
4
週
【主要評価項目】有害事象
【副次評価項目】ALSFRS-Rスコア変化量及び変化率など
【目標症例数と研究期間】
目標症例数:3例
登録予定期間:jRCT公表日~2023年11月30日、実施予定期間:jRCT公表日~2024年12月31日
37
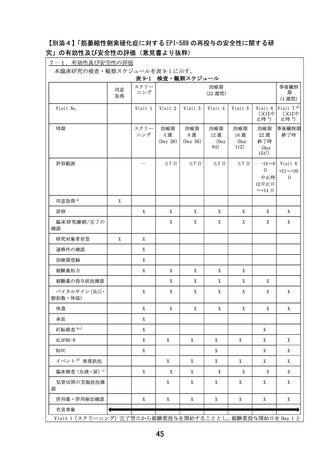
【目的】
筋萎縮性側索硬化症患者(ALS)で、過去にEPI-589を投与された患者を対象にEPI-589を再投与したときの
安全性及び忍容性を検討する。
【対象】
筋萎縮性側索硬化症患者であって、過去に約24週間のEPI-589投与あり、かつ安全性及び忍容性に問題なく、
外来通院可能な患者
【投与方法と評価スケジュール】
EPI-589 500 mg(EPI-589 250mg錠 2錠)を1日3回食前(朝食、昼食、及び夕食のそれぞれ1時間以上前)
に経口投与する。投与期間は、治療期登録翌日から治療期22週時に規定された、全ての検査・観察の終了時ま
でとする。有害事象は同意取得から事後観察期にわたって評価され、ALFRS-Rスコアなどは治療期4、8、12、
16、22週時および事後観察期4週時に評価される。
治療期
同意取得
スクリーニング
4
8
事後観察期
12
16
22
4
週
【主要評価項目】有害事象
【副次評価項目】ALSFRS-Rスコア変化量及び変化率など
【目標症例数と研究期間】
目標症例数:3例
登録予定期間:jRCT公表日~2023年11月30日、実施予定期間:jRCT公表日~2024年12月31日
37