よむ、つかう、まなぶ。
【資料3-1】新型コロナワクチン(コミナティ筋注5~ 11 歳用)の承認について(医薬・生活衛生局の説明資料) (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
いた場合、1 バイアルから 0.2 mL を 10 回分採取できることを確認した。本剤 1 バイアルから採取可能
な回数については、医療現場に情報提供する予定である。
機構は、申請者の説明を了承した。
非臨床薬理試験に関する資料及び機構における審査の概略
3.
本申請は新用量に係るものであるが、「非臨床薬理試験に関する資料」は初回承認時に評価済みであ
るとされ、新たな試験成績は提出されていない。
非臨床薬物動態試験に関する資料及び機構における審査の概略
4.
本申請は新用量に係るものであるが、「非臨床薬物動態試験に関する資料」は初回承認時に評価済み
であるとされ、新たな試験成績は提出されていない。
毒性試験に関する資料及び機構における審査の概略
5.
本申請は新用量に係るものであり、「毒性試験に関する資料」は提出されていない。
6.
生物薬剤学試験及び関連する分析法、臨床薬理試験に関する資料並びに機構における審査の概略
6.1
生物薬剤学試験及び関連する分析法
血清中の中和抗体が、蛍光タンパク質レポーター遺伝子挿入 SARS-CoV-2(参照株)を用いた中和法
(C4591007 試験)により測定された。
6.2
臨床薬理試験
本申請において「臨床薬理試験に関する資料」は提出されていない。
7.
臨床的有効性及び臨床的安全性に関する資料並びに機構における審査の概略
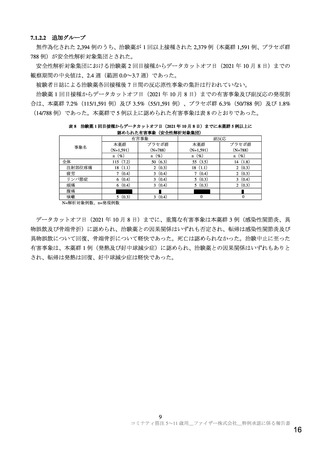
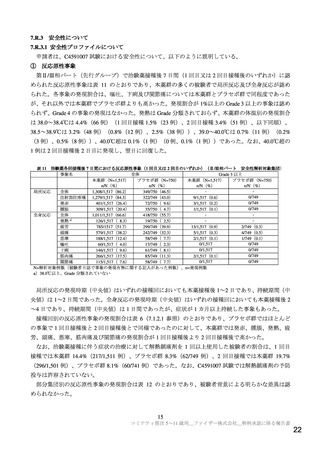
有効性及び安全性に関する評価資料として、海外第Ⅰ/Ⅱ/Ⅲ相試験(C4591007 試験)の成績が提出さ
れた。C4591007 試験では、健康小児を対象として複数の年齢層(6 カ月~1 歳、2~4 歳、5~11 歳等)
での評価が計画されているが、本申請では表 1 に示す 5~11 歳の年齢層に係る成績が提出された。
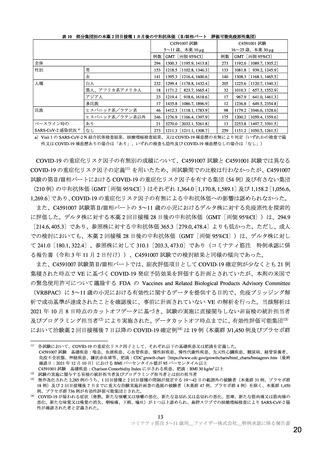
表1
実施
地域
試験名
パート
第Ⅰ相
対象
5~11 歳の
健康小児 a)
海外 C4591007
第Ⅱ/Ⅲ相
有効性及び安全性に関する資料の概要
5~11 歳の
健康小児 a)
登録例数
49 例
10 μg 群:16 例
20 μg 群:17 例
30 μg 群:16 例 b)
先行グループ:
2,285 例(本薬 1,528 例、プラセボ 757 例)
追加グループ:
2,394 例(本薬 1,598 例、プラセボ 796 例)
用法・用量の概略
本薬 c)10、20 又は 30 μg を
21 日間隔で 2 回筋肉内接種
本薬 c)10 μg 又はプラセボを
21 日間隔で 2 回筋肉内接種
主な
評価項目
安全性
忍容性
免疫原性
免疫原性
安全性
忍容性
a)状態が安定している基礎疾患を有する小児を含む
b)1 回目は 16 例に 30 μg が接種されたが、2 回目接種において 4 例に 30 μg を接種したところ、全例で発熱が認められたこと等か
ら、残り 12 例に対しては 2 回目の用量として 10 μg が接種された。
c)既承認製剤(コミナティ筋注)(充てん量:0.45 mL)と組成が同一で充てん量が異なる製剤(充てん量:0.2 mL)
3
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
10
な回数については、医療現場に情報提供する予定である。
機構は、申請者の説明を了承した。
非臨床薬理試験に関する資料及び機構における審査の概略
3.
本申請は新用量に係るものであるが、「非臨床薬理試験に関する資料」は初回承認時に評価済みであ
るとされ、新たな試験成績は提出されていない。
非臨床薬物動態試験に関する資料及び機構における審査の概略
4.
本申請は新用量に係るものであるが、「非臨床薬物動態試験に関する資料」は初回承認時に評価済み
であるとされ、新たな試験成績は提出されていない。
毒性試験に関する資料及び機構における審査の概略
5.
本申請は新用量に係るものであり、「毒性試験に関する資料」は提出されていない。
6.
生物薬剤学試験及び関連する分析法、臨床薬理試験に関する資料並びに機構における審査の概略
6.1
生物薬剤学試験及び関連する分析法
血清中の中和抗体が、蛍光タンパク質レポーター遺伝子挿入 SARS-CoV-2(参照株)を用いた中和法
(C4591007 試験)により測定された。
6.2
臨床薬理試験
本申請において「臨床薬理試験に関する資料」は提出されていない。
7.
臨床的有効性及び臨床的安全性に関する資料並びに機構における審査の概略
有効性及び安全性に関する評価資料として、海外第Ⅰ/Ⅱ/Ⅲ相試験(C4591007 試験)の成績が提出さ
れた。C4591007 試験では、健康小児を対象として複数の年齢層(6 カ月~1 歳、2~4 歳、5~11 歳等)
での評価が計画されているが、本申請では表 1 に示す 5~11 歳の年齢層に係る成績が提出された。
表1
実施
地域
試験名
パート
第Ⅰ相
対象
5~11 歳の
健康小児 a)
海外 C4591007
第Ⅱ/Ⅲ相
有効性及び安全性に関する資料の概要
5~11 歳の
健康小児 a)
登録例数
49 例
10 μg 群:16 例
20 μg 群:17 例
30 μg 群:16 例 b)
先行グループ:
2,285 例(本薬 1,528 例、プラセボ 757 例)
追加グループ:
2,394 例(本薬 1,598 例、プラセボ 796 例)
用法・用量の概略
本薬 c)10、20 又は 30 μg を
21 日間隔で 2 回筋肉内接種
本薬 c)10 μg 又はプラセボを
21 日間隔で 2 回筋肉内接種
主な
評価項目
安全性
忍容性
免疫原性
免疫原性
安全性
忍容性
a)状態が安定している基礎疾患を有する小児を含む
b)1 回目は 16 例に 30 μg が接種されたが、2 回目接種において 4 例に 30 μg を接種したところ、全例で発熱が認められたこと等か
ら、残り 12 例に対しては 2 回目の用量として 10 μg が接種された。
c)既承認製剤(コミナティ筋注)(充てん量:0.45 mL)と組成が同一で充てん量が異なる製剤(充てん量:0.2 mL)
3
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
10