よむ、つかう、まなぶ。
【資料3-1】新型コロナワクチン(コミナティ筋注5~ 11 歳用)の承認について(医薬・生活衛生局の説明資料) (29 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
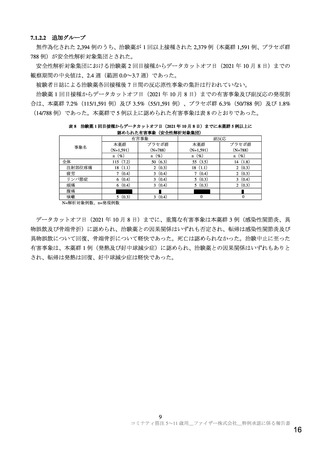
を有する小児等では重症化リスクが高いこと、小児の COVID-19 患者で MIS-C/PIMS 等の重症合併症
も報告されていること、今後感染再拡大が起こる可能性等も考慮すると、小児に対して本剤を接種可
能な状態にすることは一定の意義があると判断する。一方で、健康な小児は COVID-19 に罹患しても多
くが軽症であること等も踏まえると、本邦の現時点の感染流行状況においては、すべての小児に対して
早急に SARS-CoV-2 ワクチン接種が必要な状況とはいえない。SARS-CoV-2 ワクチン接種により期待さ
れるベネフィットとリスクのバランスは、感染流行状況、被接種者の基礎疾患の有無等により異なる。
医療従事者、被接種者及びその保護者が、本剤接種により小児で期待されるベネフィットと副反応等の
リスクを理解した上で、接種の必要性を判断できるよう、十分に情報提供がなされることが重要である。
7.R.5
用法・用量について
本剤は 5~11 歳の小児用の製剤として開発されており、申請時の用法・用量は、1 回 0.2 mL を 21 日
間隔で 2 回筋肉内接種するとされている。
申請者は、用量設定及び対象年齢について、以下のように説明している。
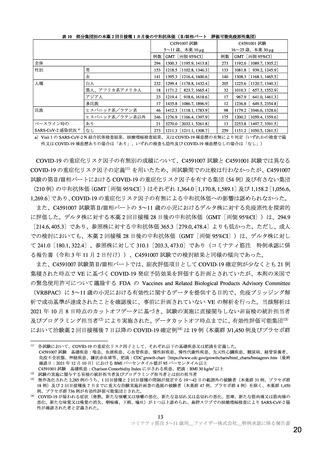
用量設定試験として実施したC4591007試験の第Ⅰ相パート(7.1.1参照)では、5~11歳の小児に本薬
10 µg、20 µg又は30 µgを21日間隔で2回接種したときの安全性、忍容性及び免疫原性について検討した。
接種回数及び接種間隔は、既承認の12歳以上の者に対する用法と同様に設定した。その結果、本薬10 µg
群の忍容性は確認されたが、より高用量では反応原性事象の発現割合や重症度が高い傾向が認められ、
また本剤接種後の中和抗体価は、本薬10 µg群と20 µg群とで同程度であったことから、第Ⅱ/Ⅲ相パート
の5~11歳の小児に対する本薬の用法・用量は、1回10 µgを21日間隔(許容期間は19~23日)で2回接種
することと設定した。第Ⅱ/Ⅲ相パートにおける免疫原性の結果から5~11歳の小児における有効性は期
待でき(7.R.2参照)、安全性及び忍容性は許容可能と判断したことから(7.R.3参照)、5~11歳の小児に
対する本剤の用法・用量を1回10 µgを21日間隔で2回接種と設定した。
なお、5 歳未満の小児については、現在臨床試験実施中であり、製剤も開発中である。
機構は、以上の申請者の説明、並びに 7.R.2 及び 7.R.3 の検討を踏まえ、接種対象者を 5~11 歳の小児
とし、本剤の用法・用量を申請内容のとおりに設定することは可能と判断した。
7.R.6
7.R.6.1
製造販売後の検討事項について
製造販売後の調査について
申請者は、製造販売後の調査について、以下のように説明している。
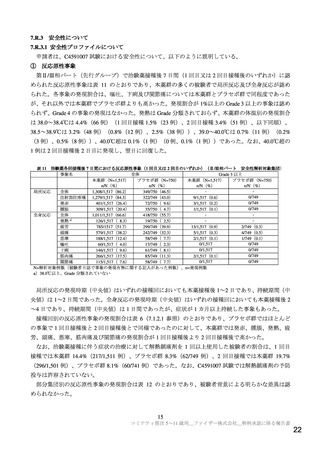
C4591007 試験において、5~11 歳の小児における本剤の安全性に重大な懸念は認められていない
(7.R.3 参照)。しかしながら、当該年齢層の日本人小児における本剤の安全性情報は得られていないこ
とから、本剤の製造販売後には 5~11 歳の小児における本剤の使用実態下の安全性情報を速やかに収集・
公表するために、特定使用成績調査(観察期間は 1 回目接種日から 2 回目接種後 28 日)の実施を計画し
ている。
機構は、製造販売後の調査等において、5~11 歳の小児については、基礎疾患を有する小児も含めて、
本剤の使用実態下における安全性情報を速やかに収集し、得られた情報を速やかに医療現場に提供する
必要があると考える。
22
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
29
も報告されていること、今後感染再拡大が起こる可能性等も考慮すると、小児に対して本剤を接種可
能な状態にすることは一定の意義があると判断する。一方で、健康な小児は COVID-19 に罹患しても多
くが軽症であること等も踏まえると、本邦の現時点の感染流行状況においては、すべての小児に対して
早急に SARS-CoV-2 ワクチン接種が必要な状況とはいえない。SARS-CoV-2 ワクチン接種により期待さ
れるベネフィットとリスクのバランスは、感染流行状況、被接種者の基礎疾患の有無等により異なる。
医療従事者、被接種者及びその保護者が、本剤接種により小児で期待されるベネフィットと副反応等の
リスクを理解した上で、接種の必要性を判断できるよう、十分に情報提供がなされることが重要である。
7.R.5
用法・用量について
本剤は 5~11 歳の小児用の製剤として開発されており、申請時の用法・用量は、1 回 0.2 mL を 21 日
間隔で 2 回筋肉内接種するとされている。
申請者は、用量設定及び対象年齢について、以下のように説明している。
用量設定試験として実施したC4591007試験の第Ⅰ相パート(7.1.1参照)では、5~11歳の小児に本薬
10 µg、20 µg又は30 µgを21日間隔で2回接種したときの安全性、忍容性及び免疫原性について検討した。
接種回数及び接種間隔は、既承認の12歳以上の者に対する用法と同様に設定した。その結果、本薬10 µg
群の忍容性は確認されたが、より高用量では反応原性事象の発現割合や重症度が高い傾向が認められ、
また本剤接種後の中和抗体価は、本薬10 µg群と20 µg群とで同程度であったことから、第Ⅱ/Ⅲ相パート
の5~11歳の小児に対する本薬の用法・用量は、1回10 µgを21日間隔(許容期間は19~23日)で2回接種
することと設定した。第Ⅱ/Ⅲ相パートにおける免疫原性の結果から5~11歳の小児における有効性は期
待でき(7.R.2参照)、安全性及び忍容性は許容可能と判断したことから(7.R.3参照)、5~11歳の小児に
対する本剤の用法・用量を1回10 µgを21日間隔で2回接種と設定した。
なお、5 歳未満の小児については、現在臨床試験実施中であり、製剤も開発中である。
機構は、以上の申請者の説明、並びに 7.R.2 及び 7.R.3 の検討を踏まえ、接種対象者を 5~11 歳の小児
とし、本剤の用法・用量を申請内容のとおりに設定することは可能と判断した。
7.R.6
7.R.6.1
製造販売後の検討事項について
製造販売後の調査について
申請者は、製造販売後の調査について、以下のように説明している。
C4591007 試験において、5~11 歳の小児における本剤の安全性に重大な懸念は認められていない
(7.R.3 参照)。しかしながら、当該年齢層の日本人小児における本剤の安全性情報は得られていないこ
とから、本剤の製造販売後には 5~11 歳の小児における本剤の使用実態下の安全性情報を速やかに収集・
公表するために、特定使用成績調査(観察期間は 1 回目接種日から 2 回目接種後 28 日)の実施を計画し
ている。
機構は、製造販売後の調査等において、5~11 歳の小児については、基礎疾患を有する小児も含めて、
本剤の使用実態下における安全性情報を速やかに収集し、得られた情報を速やかに医療現場に提供する
必要があると考える。
22
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
29