よむ、つかう、まなぶ。
【資料3-1】新型コロナワクチン(コミナティ筋注5~ 11 歳用)の承認について(医薬・生活衛生局の説明資料) (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
審議結果報告書
令 和 4 年 1 月 20 日
医薬・生活衛生局医薬品審査管理課
[販
[一
売
般
名]
名]
[申 請 者 名]
[申請年月日]
コミナティ筋注5~11歳用
コロナウイルス修飾ウリジンRNAワクチン(SARS-CoV-2)
(有効成分名:トジナメラン)
ファイザー株式会社
令和3年11月10日
[審 議 結 果]
本品目は、新型コロナウイルス(SARS-CoV-2)による感染症が世界的に流行
している昨今の状況において、医薬品、医療機器等の品質、有効性及び安全性
の確保等に関する法律(昭和 35 年法律第 145 号。以下「医薬品医療機器等法」
という。)第 14 条の3第1項に基づく承認に該当することが見込まれるとし
て、承認申請があったものである。
本品目については、令和4年1月 20 日に開催された医薬品第二部会におい
て、医薬品医療機器等法第 14 条の3第1項の規定による特例承認の可否につ
いて審議された。その結果、下記の承認条件が付されることを前提として、承
認して差し支えないものとされ、薬事・食品衛生審議会薬事分科会に報告する
こととされた。
本品目の再審査期間は残余期間(令和 11 年2月 13 日まで)とされた。
[承 認 条 件]
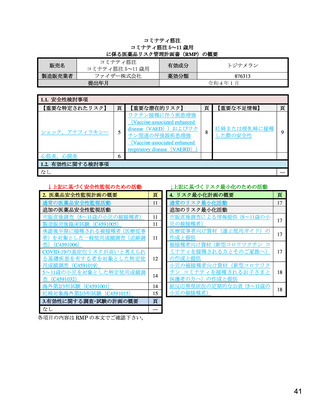
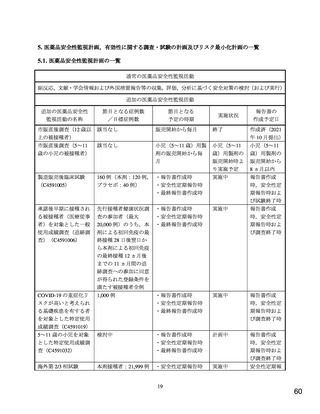
1. 医薬品リスク管理計画を策定の上、適切に実施すること。
2. 本剤は、医薬品医療機器等法第 14 条の 3 第 1 項の規定に基づき承認された
特例承認品目であり、承認時において長期安定性に係る情報は限られてい
るため、製造販売後も引き続き情報を収集し、報告すること。
3. 現時点での知見が限られていることから、製造販売後、副反応情報等の本剤
の安全性に関するデータを、あらかじめ定めた計画に基づき早期に収集す
るとともに、独立行政法人医薬品医療機器総合機構に提出し、本剤の適正使
用に必要な措置を講じること。その際、国が実施する健康調査等により得ら
れた情報についても適切に反映すること。
4. 現在国内外で実施中又は計画中の臨床試験の成績が得られた際には、速や
かに当該成績を独立行政法人医薬品医療機器総合機構に提出するとともに、
4
令 和 4 年 1 月 20 日
医薬・生活衛生局医薬品審査管理課
[販
[一
売
般
名]
名]
[申 請 者 名]
[申請年月日]
コミナティ筋注5~11歳用
コロナウイルス修飾ウリジンRNAワクチン(SARS-CoV-2)
(有効成分名:トジナメラン)
ファイザー株式会社
令和3年11月10日
[審 議 結 果]
本品目は、新型コロナウイルス(SARS-CoV-2)による感染症が世界的に流行
している昨今の状況において、医薬品、医療機器等の品質、有効性及び安全性
の確保等に関する法律(昭和 35 年法律第 145 号。以下「医薬品医療機器等法」
という。)第 14 条の3第1項に基づく承認に該当することが見込まれるとし
て、承認申請があったものである。
本品目については、令和4年1月 20 日に開催された医薬品第二部会におい
て、医薬品医療機器等法第 14 条の3第1項の規定による特例承認の可否につ
いて審議された。その結果、下記の承認条件が付されることを前提として、承
認して差し支えないものとされ、薬事・食品衛生審議会薬事分科会に報告する
こととされた。
本品目の再審査期間は残余期間(令和 11 年2月 13 日まで)とされた。
[承 認 条 件]
1. 医薬品リスク管理計画を策定の上、適切に実施すること。
2. 本剤は、医薬品医療機器等法第 14 条の 3 第 1 項の規定に基づき承認された
特例承認品目であり、承認時において長期安定性に係る情報は限られてい
るため、製造販売後も引き続き情報を収集し、報告すること。
3. 現時点での知見が限られていることから、製造販売後、副反応情報等の本剤
の安全性に関するデータを、あらかじめ定めた計画に基づき早期に収集す
るとともに、独立行政法人医薬品医療機器総合機構に提出し、本剤の適正使
用に必要な措置を講じること。その際、国が実施する健康調査等により得ら
れた情報についても適切に反映すること。
4. 現在国内外で実施中又は計画中の臨床試験の成績が得られた際には、速や
かに当該成績を独立行政法人医薬品医療機器総合機構に提出するとともに、
4