よむ、つかう、まなぶ。
【資料3-1】新型コロナワクチン(コミナティ筋注5~ 11 歳用)の承認について(医薬・生活衛生局の説明資料) (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
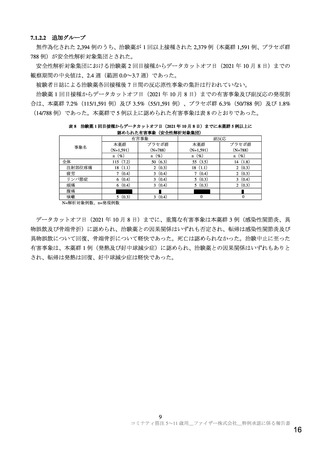
る症例は認められないものの、mRNA ワクチンの接種と心筋炎関連事象による死亡との因果関係に関し
て注視すべき状況にあるとされた。一方で、ワクチン接種後の心筋炎の発生頻度は、COVID-19 に合併
する心筋炎関連事象の発生頻度よりも低いことから、10 代及び 20 代の男性も含めて SARS-CoV-2 ワク
チンは引き続き接種可能と判断された。
現時点で本薬接種を受けた 5~11 歳の小児の情報は限られているが、上述のとおり、若年層における
ワクチン接種後の心筋炎・心膜炎の発生頻度は COVID-19 に合併する心筋炎関連事象の発生頻度よりも
低く、発現したとしてもほとんどが無症状又は軽症であることや(Circulation 2021; 144: 471-84 等)、年
齢層別の発生状況を踏まえると、現時点で 5~11 歳の小児において許容できないリスクを示唆する情報
は得られていない。小児の COVID-19 は比較的軽症とされているものの、重症化する場合もあり、COVID19 の合併症(心筋炎や MIS-C/PIMS 等)のリスクも考慮すると、5~11 歳の小児に対しても本剤を接種
可能な状態にすることは重要と考える。
また、当該年齢の小児は心筋炎・心膜炎が発現したとしても症状(胸の痛みや息切れ)を自覚し訴え
ることが難しい可能性があると考えることから、情報提供資材で具体的な症状を情報提供し、児の体調
の変化や症状の訴えがあった場合に医師に連絡するよう注意喚起するとの申請者の対応は適切と考える。
ただし、小児における心筋炎・心膜炎については、引き続き国内外の情報を収集し、得られた情報に
基づき、適切な対応を検討する必要がある。
7.R.3.4
本薬の製造販売後等の安全性情報について
申請者は、本薬の製造販売後等における安全性情報のうち小児に関する報告について、以下のように
説明している。
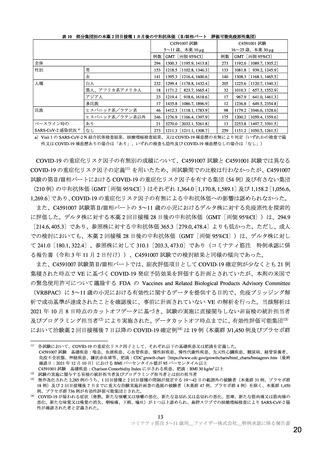
申請者の安全性データベースにおいて、2020 年 12 月 19 日~2021 年 9 月 30 日に、5~11 歳の小児に
おける報告21)は 140 例 309 件あり、92 例は臨床的事象を伴わないイベント22)の報告であり、残りの 48
例で 124 件の臨床的事象の報告があった。3 件以上報告された事象は、発熱 12 件、四肢痛 11 件、頭痛
9 件、ワクチン接種部位疼痛 6 件、疲労 5 件、疼痛 4 件、下痢、悪心、口腔咽頭痛、末梢腫脹及びそう
痒症各 3 件であった。重篤な報告は 8 例 20 件あり、頭痛 3 件、発熱及び末梢腫脹各 2 件、心粗動、心筋
炎、アフタ性潰瘍、下痢、口内炎、嘔吐、腫脹、ヘルペスウイルス感染、乳腺炎、四肢痛、痙攣発作、
不適切な年齢の患者への製品適用及びそう痒症各 1 件であり、転帰は回復又は軽快 8 件(発熱及び頭痛
各 2 件、腫脹、痙攣発作、嘔吐及び下痢各 1 件)、未回復 6 件(心粗動、末梢腫脹、アフタ性潰瘍、口
内炎、乳腺炎及びそう痒症各 1 件)、その他は不明であった。また、2021 年 10 月 1 日~同年 10 月 28
日に 12 歳未満の小児における報告は 62 例 132 件あり、3 件以上報告された事象は不適切な年齢の患者
への製品適用 44 件、適応外使用 13 件、製品使用の問題 10 件、発熱及び誤った製品の適用各 5 件、頭痛
4 件、四肢痛 3 件であり、症例の転帰は回復又は軽快が 10 例、未回復が 3 例、その他は不明であった。
なお、5~11 歳の小児について、本剤の最初の製造販売承認又は緊急使用許可は 2021 年 10 月 29 日で
あり、現時点で得られている情報は限られることから、小児のプロファイルとして、12~15 歳(承認用
量は 30 µg)における報告も確認した。2021 年 10 月 1 日~同年 10 月 28 日に 12~15 歳の小児における
報告は 1,502 例 5,069 件あり、100 件以上報告された事象は頭痛 317 件、発熱 292 件、疲労 170 件、悪心
5~11 歳の小児に対する本剤の製造販売承認又は使用許可前の報告である。接種用量が確認可能な 13 例において、接種用量は 0.1 mL
(1 例)、0.15 mL(2 例)又は 0.3 mL(10 例)であった。
22)
子供の偶発的製品曝露、偶発的過少量投与、投薬過誤につながる状況または情報、不適切な製品適用計画、誤用量投与、誤った製品
適用経路、適応外使用、不適切な年齢の患者への製品適用、製品使用の問題、予想外の治療反応、過少量投与、ワクチン接種過誤、
誤った患者への製品適用
21)
20
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
27
て注視すべき状況にあるとされた。一方で、ワクチン接種後の心筋炎の発生頻度は、COVID-19 に合併
する心筋炎関連事象の発生頻度よりも低いことから、10 代及び 20 代の男性も含めて SARS-CoV-2 ワク
チンは引き続き接種可能と判断された。
現時点で本薬接種を受けた 5~11 歳の小児の情報は限られているが、上述のとおり、若年層における
ワクチン接種後の心筋炎・心膜炎の発生頻度は COVID-19 に合併する心筋炎関連事象の発生頻度よりも
低く、発現したとしてもほとんどが無症状又は軽症であることや(Circulation 2021; 144: 471-84 等)、年
齢層別の発生状況を踏まえると、現時点で 5~11 歳の小児において許容できないリスクを示唆する情報
は得られていない。小児の COVID-19 は比較的軽症とされているものの、重症化する場合もあり、COVID19 の合併症(心筋炎や MIS-C/PIMS 等)のリスクも考慮すると、5~11 歳の小児に対しても本剤を接種
可能な状態にすることは重要と考える。
また、当該年齢の小児は心筋炎・心膜炎が発現したとしても症状(胸の痛みや息切れ)を自覚し訴え
ることが難しい可能性があると考えることから、情報提供資材で具体的な症状を情報提供し、児の体調
の変化や症状の訴えがあった場合に医師に連絡するよう注意喚起するとの申請者の対応は適切と考える。
ただし、小児における心筋炎・心膜炎については、引き続き国内外の情報を収集し、得られた情報に
基づき、適切な対応を検討する必要がある。
7.R.3.4
本薬の製造販売後等の安全性情報について
申請者は、本薬の製造販売後等における安全性情報のうち小児に関する報告について、以下のように
説明している。
申請者の安全性データベースにおいて、2020 年 12 月 19 日~2021 年 9 月 30 日に、5~11 歳の小児に
おける報告21)は 140 例 309 件あり、92 例は臨床的事象を伴わないイベント22)の報告であり、残りの 48
例で 124 件の臨床的事象の報告があった。3 件以上報告された事象は、発熱 12 件、四肢痛 11 件、頭痛
9 件、ワクチン接種部位疼痛 6 件、疲労 5 件、疼痛 4 件、下痢、悪心、口腔咽頭痛、末梢腫脹及びそう
痒症各 3 件であった。重篤な報告は 8 例 20 件あり、頭痛 3 件、発熱及び末梢腫脹各 2 件、心粗動、心筋
炎、アフタ性潰瘍、下痢、口内炎、嘔吐、腫脹、ヘルペスウイルス感染、乳腺炎、四肢痛、痙攣発作、
不適切な年齢の患者への製品適用及びそう痒症各 1 件であり、転帰は回復又は軽快 8 件(発熱及び頭痛
各 2 件、腫脹、痙攣発作、嘔吐及び下痢各 1 件)、未回復 6 件(心粗動、末梢腫脹、アフタ性潰瘍、口
内炎、乳腺炎及びそう痒症各 1 件)、その他は不明であった。また、2021 年 10 月 1 日~同年 10 月 28
日に 12 歳未満の小児における報告は 62 例 132 件あり、3 件以上報告された事象は不適切な年齢の患者
への製品適用 44 件、適応外使用 13 件、製品使用の問題 10 件、発熱及び誤った製品の適用各 5 件、頭痛
4 件、四肢痛 3 件であり、症例の転帰は回復又は軽快が 10 例、未回復が 3 例、その他は不明であった。
なお、5~11 歳の小児について、本剤の最初の製造販売承認又は緊急使用許可は 2021 年 10 月 29 日で
あり、現時点で得られている情報は限られることから、小児のプロファイルとして、12~15 歳(承認用
量は 30 µg)における報告も確認した。2021 年 10 月 1 日~同年 10 月 28 日に 12~15 歳の小児における
報告は 1,502 例 5,069 件あり、100 件以上報告された事象は頭痛 317 件、発熱 292 件、疲労 170 件、悪心
5~11 歳の小児に対する本剤の製造販売承認又は使用許可前の報告である。接種用量が確認可能な 13 例において、接種用量は 0.1 mL
(1 例)、0.15 mL(2 例)又は 0.3 mL(10 例)であった。
22)
子供の偶発的製品曝露、偶発的過少量投与、投薬過誤につながる状況または情報、不適切な製品適用計画、誤用量投与、誤った製品
適用経路、適応外使用、不適切な年齢の患者への製品適用、製品使用の問題、予想外の治療反応、過少量投与、ワクチン接種過誤、
誤った患者への製品適用
21)
20
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
27