よむ、つかう、まなぶ。
【資料3-1】新型コロナワクチン(コミナティ筋注5~ 11 歳用)の承認について(医薬・生活衛生局の説明資料) (32 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
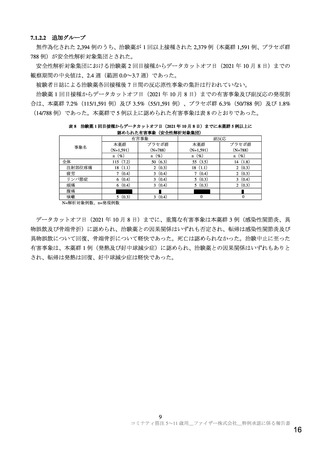
すべての症例がレベル 4 であり、現時点でこれらの報告に基づき 5~11 歳の小児における心筋炎・心膜
炎の発現リスクについて結論付けることは困難である。
機構は、現時点では、報告(1)に記載した機構の意見に加えて追加の対応が必要な情報は得られてい
ないと考える。報告(1)に記載のとおり、心筋炎・心膜炎の発現状況及び発現リスクについて、引き続
き国内外の情報の収集、分析等を行い、必要に応じて追加の注意喚起や情報提供の要否等の対応を検討
するよう申請者に伝達し、申請者は適切に対応する旨回答した。
1.3
臨床的位置付けについて
専門協議では、報告(1)の「7.R.4 臨床的位置付け」の機構の判断は、専門委員から支持された。
1.4
用法・用量について
専門協議では、報告(1)の「7.R.5 用法・用量について」の機構の判断は、専門委員から支持され
た。
1.5
医薬品リスク管理計画(案)について
専門協議では、審査報告(1)の「7.R.6 製造販売後の検討事項について」の機構の判断は、専門委員
から支持された。
機構は、現時点における本剤の医薬品リスク管理計画(案)について、表 13 に示す安全性検討事項を
設定すること、及び表 14 に示す追加の医薬品安全性監視活動及び追加のリスク最小化活動を実施する
ことが適切と判断した。
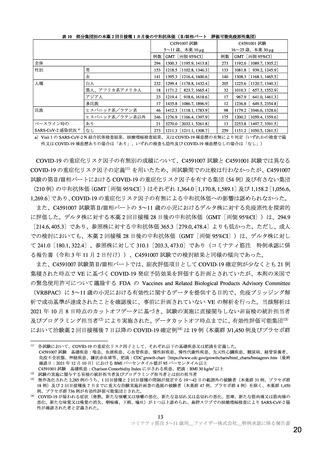
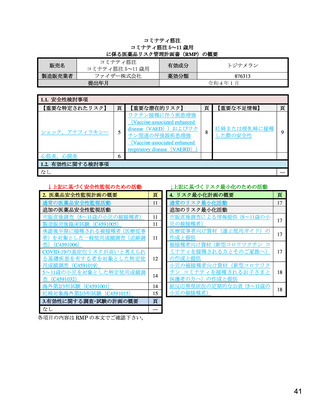
表 13 医薬品リスク管理計画(案)における安全性検討事項及び有効性に関する検討事項
安全性検討事項
重要な特定されたリスク
重要な潜在的リスク
重要な不足情報
ショック、アナフィラキシー
ワクチン接種に伴う疾患増強(Vaccine-associated 妊婦又は授乳婦に接種した際の安全
心筋炎、心膜炎
enhanced disease(VAED))及びワクチン関連の
性
呼 吸 器 疾 患 増 強 ( Vaccine-associated enhanced
respiratory disease(VAERD))
有効性に関する検討事項
該当なし
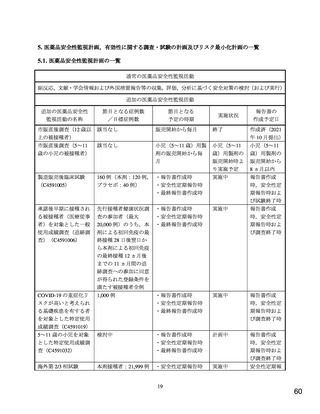
表 14
医薬品リスク管理計画(案)における追加の医薬品安全性監視活動及び追加のリスク最小化活動の概要
追加の医薬品安全性監視活動
追加のリスク最小化活動
市販直後調査(5~11 歳の小児の被接種者)
市販直後調査による情報提供(5~11 歳の小児の被接種者)
製造販売後臨床試験(C4591005)
医療従事者向け資材(適正使用ガイド)の作成と提供
承認後早期に接種される被接種者(医療従事者)を対象とした 被接種者向け資材(新型コロナワクチンコミナティを接種される
一般使用成績調査(追跡調査)(C4591006)
方とそのご家族へ)の作成と提供
COVID-19 の重症化リスクが高いと考えられる基礎疾患を有す 小児の被接種者向け資材(新型コロナワクチンコミナティを接種
る者を対象とした特定使用成績調査(C4591019)
されるお子さまと保護者の方へ)の作成と提供
5~11 歳の小児を対象とした特定使用成績調査(C4591032)a) 副反応発現状況の定期的な公表(5~11 歳の小児の被接種者)
海外第 2/3 相試験(C4591001)
妊婦対象海外第 2/3 相試験(C4591015)
下線部:今回の申請に伴う変更
a)国主導のコホート調査の有無、調査内容を踏まえて検討予定
25
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
32
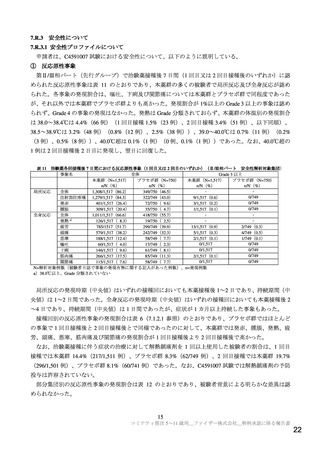
炎の発現リスクについて結論付けることは困難である。
機構は、現時点では、報告(1)に記載した機構の意見に加えて追加の対応が必要な情報は得られてい
ないと考える。報告(1)に記載のとおり、心筋炎・心膜炎の発現状況及び発現リスクについて、引き続
き国内外の情報の収集、分析等を行い、必要に応じて追加の注意喚起や情報提供の要否等の対応を検討
するよう申請者に伝達し、申請者は適切に対応する旨回答した。
1.3
臨床的位置付けについて
専門協議では、報告(1)の「7.R.4 臨床的位置付け」の機構の判断は、専門委員から支持された。
1.4
用法・用量について
専門協議では、報告(1)の「7.R.5 用法・用量について」の機構の判断は、専門委員から支持され
た。
1.5
医薬品リスク管理計画(案)について
専門協議では、審査報告(1)の「7.R.6 製造販売後の検討事項について」の機構の判断は、専門委員
から支持された。
機構は、現時点における本剤の医薬品リスク管理計画(案)について、表 13 に示す安全性検討事項を
設定すること、及び表 14 に示す追加の医薬品安全性監視活動及び追加のリスク最小化活動を実施する
ことが適切と判断した。
表 13 医薬品リスク管理計画(案)における安全性検討事項及び有効性に関する検討事項
安全性検討事項
重要な特定されたリスク
重要な潜在的リスク
重要な不足情報
ショック、アナフィラキシー
ワクチン接種に伴う疾患増強(Vaccine-associated 妊婦又は授乳婦に接種した際の安全
心筋炎、心膜炎
enhanced disease(VAED))及びワクチン関連の
性
呼 吸 器 疾 患 増 強 ( Vaccine-associated enhanced
respiratory disease(VAERD))
有効性に関する検討事項
該当なし
表 14
医薬品リスク管理計画(案)における追加の医薬品安全性監視活動及び追加のリスク最小化活動の概要
追加の医薬品安全性監視活動
追加のリスク最小化活動
市販直後調査(5~11 歳の小児の被接種者)
市販直後調査による情報提供(5~11 歳の小児の被接種者)
製造販売後臨床試験(C4591005)
医療従事者向け資材(適正使用ガイド)の作成と提供
承認後早期に接種される被接種者(医療従事者)を対象とした 被接種者向け資材(新型コロナワクチンコミナティを接種される
一般使用成績調査(追跡調査)(C4591006)
方とそのご家族へ)の作成と提供
COVID-19 の重症化リスクが高いと考えられる基礎疾患を有す 小児の被接種者向け資材(新型コロナワクチンコミナティを接種
る者を対象とした特定使用成績調査(C4591019)
されるお子さまと保護者の方へ)の作成と提供
5~11 歳の小児を対象とした特定使用成績調査(C4591032)a) 副反応発現状況の定期的な公表(5~11 歳の小児の被接種者)
海外第 2/3 相試験(C4591001)
妊婦対象海外第 2/3 相試験(C4591015)
下線部:今回の申請に伴う変更
a)国主導のコホート調査の有無、調査内容を踏まえて検討予定
25
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
32