よむ、つかう、まなぶ。
【資料3-1】新型コロナワクチン(コミナティ筋注5~ 11 歳用)の承認について(医薬・生活衛生局の説明資料) (49 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
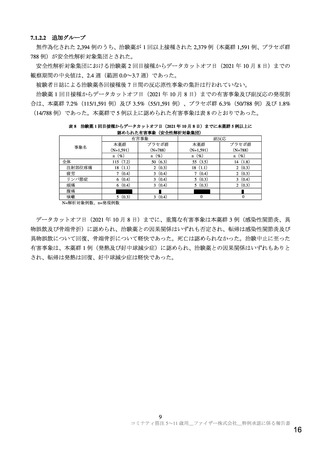
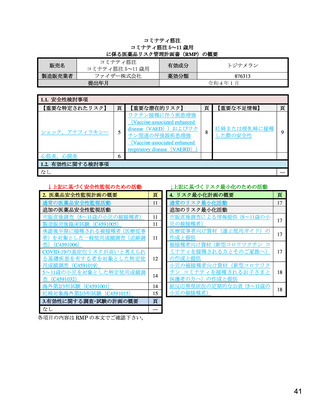
重要な潜在的リスク
ワクチン接種に伴う疾患増強(Vaccine-associated enhanced disease(VAED))およびワクチン関連の呼吸
器疾患増強(Vaccine-associated enhanced respiratory disease(VAERD))
重要な潜在的リスクとした理由:
本剤の臨床試験において報告されていないものの,以下の報告を踏まえ,本剤の接種を受けた者
が SARS-CoV-2 感染症に罹患した場合,VAED/VAERD により重症化する可能性があると考えら
れることから重要な潜在的リスクとした。
SARS-CoV-1 ワクチン候補を評価するために開発された動物モデル(マウス,フェレットおよび
非ヒト霊長類)では,一部の研究で生ワクチン接種後のウイルス曝露時に疾患増強が認められた。
また一部の MARS ワクチン候補において,マウスモデルで疾患増強が認められた a) b)。
疾患増強の潜在的なメカニズムは,T 細胞媒介性(Th1 よりも Th2 による免疫病理学的反応)と
抗体媒介性(中和活性が不十分な抗体反応が導く免疫複合体の形成および補体の活性化もしくは
Fc を介したウイルス侵入の増加)の両方であると考えられている c)。
a) Lambert PH, Ambrosino DM, Andersen SR, et al. Consensus summary report for CEPI/BC March 12–13, 2020 meeting:
Assessment of risk of disease enhancement with COVID-19 vaccines. Vaccine 2020; 38(31):4783-91.
b) Haynes BF, Corey L, Fernandes P, et al. Prospects for a safe COVID-19 vaccine. Sci Transl Med 2020;12(568):eabe0948
c) Graham BS. Rapid COVID-19 vaccine development. Science 2020;368(6494):945-6.
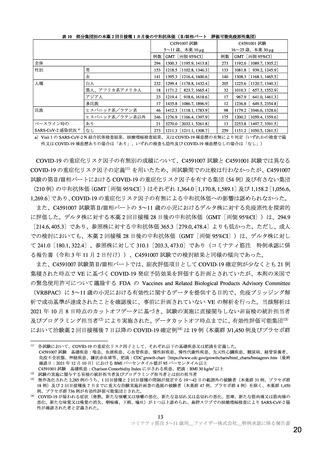
医薬品安全性監視活動の内容及びその選択理由:
【内容】
通常の医薬品安全性監視活動
追加の医薬品安全性監視活動として,以下を実施する。
1. 製造販売後臨床試験(C4591005)
2. 使用成績調査[一般使用成績調査(C4591006)および特定使用成績調査(C4591019 お
よび C4591032)]
3. 海外第 2/3 相試験(C4591001)
【選択理由】
本剤接種後の長期的な安全性情報を収集し,慎重に評価することを目的に,製造販売後臨床
試験および本剤承認後の使用実態下において,ワクチン接種に伴う疾患増強(VAED)およ
びワクチン関連の呼吸器疾患増強(VAERD)の発現の有無を確認するため。また,海外臨
床試験から情報収集を行うため。なお,本邦においてワクチン接種情報を有する医療情報
データベースは承認時点で存在しないが,将来的に当該事象の評価が可能なデータベースが
整備された場合には製造販売後データベース調査の実施を検討する。
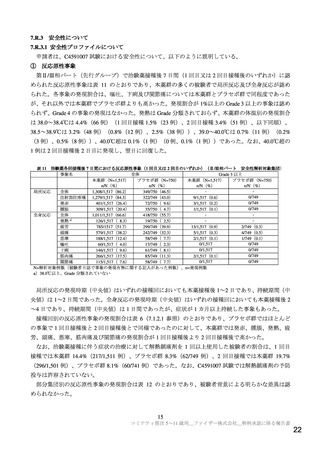
リスク最小化活動の内容及びその選択理由:
【内容】
通常のリスク最小化活動は行わない。
追加のリスク最小化活動として,以下を実施する。
1. 医療従事者向け資材(適正使用ガイド)の作成と提供
【選択理由】
本リスクに関する情報を医療従事者向け資材(適正使用ガイド)で提供し,本剤の適正使用
を促し,安全性の確保を図るため。
8
49
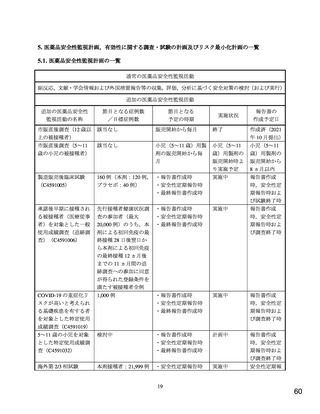
ワクチン接種に伴う疾患増強(Vaccine-associated enhanced disease(VAED))およびワクチン関連の呼吸
器疾患増強(Vaccine-associated enhanced respiratory disease(VAERD))
重要な潜在的リスクとした理由:
本剤の臨床試験において報告されていないものの,以下の報告を踏まえ,本剤の接種を受けた者
が SARS-CoV-2 感染症に罹患した場合,VAED/VAERD により重症化する可能性があると考えら
れることから重要な潜在的リスクとした。
SARS-CoV-1 ワクチン候補を評価するために開発された動物モデル(マウス,フェレットおよび
非ヒト霊長類)では,一部の研究で生ワクチン接種後のウイルス曝露時に疾患増強が認められた。
また一部の MARS ワクチン候補において,マウスモデルで疾患増強が認められた a) b)。
疾患増強の潜在的なメカニズムは,T 細胞媒介性(Th1 よりも Th2 による免疫病理学的反応)と
抗体媒介性(中和活性が不十分な抗体反応が導く免疫複合体の形成および補体の活性化もしくは
Fc を介したウイルス侵入の増加)の両方であると考えられている c)。
a) Lambert PH, Ambrosino DM, Andersen SR, et al. Consensus summary report for CEPI/BC March 12–13, 2020 meeting:
Assessment of risk of disease enhancement with COVID-19 vaccines. Vaccine 2020; 38(31):4783-91.
b) Haynes BF, Corey L, Fernandes P, et al. Prospects for a safe COVID-19 vaccine. Sci Transl Med 2020;12(568):eabe0948
c) Graham BS. Rapid COVID-19 vaccine development. Science 2020;368(6494):945-6.
医薬品安全性監視活動の内容及びその選択理由:
【内容】
通常の医薬品安全性監視活動
追加の医薬品安全性監視活動として,以下を実施する。
1. 製造販売後臨床試験(C4591005)
2. 使用成績調査[一般使用成績調査(C4591006)および特定使用成績調査(C4591019 お
よび C4591032)]
3. 海外第 2/3 相試験(C4591001)
【選択理由】
本剤接種後の長期的な安全性情報を収集し,慎重に評価することを目的に,製造販売後臨床
試験および本剤承認後の使用実態下において,ワクチン接種に伴う疾患増強(VAED)およ
びワクチン関連の呼吸器疾患増強(VAERD)の発現の有無を確認するため。また,海外臨
床試験から情報収集を行うため。なお,本邦においてワクチン接種情報を有する医療情報
データベースは承認時点で存在しないが,将来的に当該事象の評価が可能なデータベースが
整備された場合には製造販売後データベース調査の実施を検討する。
リスク最小化活動の内容及びその選択理由:
【内容】
通常のリスク最小化活動は行わない。
追加のリスク最小化活動として,以下を実施する。
1. 医療従事者向け資材(適正使用ガイド)の作成と提供
【選択理由】
本リスクに関する情報を医療従事者向け資材(適正使用ガイド)で提供し,本剤の適正使用
を促し,安全性の確保を図るため。
8
49