よむ、つかう、まなぶ。
【資料3-1】新型コロナワクチン(コミナティ筋注5~ 11 歳用)の承認について(医薬・生活衛生局の説明資料) (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
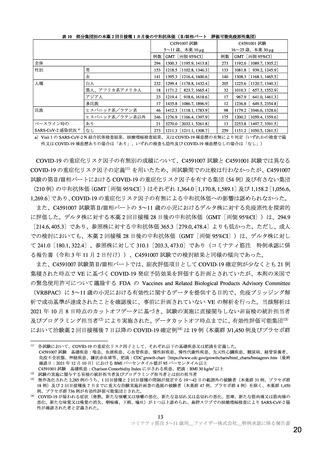
以上の①~③で示したとおり、C4591007 試験において本薬を接種された被験者の多くで反応原性事象
(局所反応及び全身反応)が認められたが、ほとんどは軽度又は中等度であり、症状発現後短時間で消
失しており、これまでに 12 歳以上で確認されているプロファイルと同様であった。また、反応原性事象
以外の有害事象の発現割合は低くほとんどは軽度又は中等度であり、本薬との因果関係が否定されない
重篤な有害事象は認められていないこと等から、現時点で 5~11 歳の小児における本薬の安全性に重大
な懸念は認められておらず、忍容性は確認されたと考える。
なお、C4591007 試験において、治験薬と他の感染症予防ワクチンを同時接種された被験者はいなかっ
た16)。治験薬 1 回目接種以降に他の感染症予防ワクチンが接種された被験者は本薬群 10/1,518 例及びプ
ラセボ群 6/750 例17)確認されたが、治験薬最終接種後 1 カ月までの有害事象は本薬群では認められず、
プラセボ群 2 例に認められた。
機構は、以下のように考える。
C4591007 試験において、被験者の多くに反応原性事象(局所反応及び全身反応)が認められたものの、
ほとんどが軽度又は中等度であり回復性が認められていること、反応原性事象以外の有害事象の発現割
合は低くほとんどは軽度又は中等度であること等を確認し、現時点で得られている情報からは、5~11 歳
の小児における本薬の安全性に重大な懸念は認められていないと判断した。ただし、5~11 歳の小児に
おける安全性情報は限られていること等から、製造販売後には当該年齢層の小児における本剤の安全性
について情報収集し、得られた情報に基づき適切に対応する必要がある。また、局所反応や全身反応が
多くの被験者に認められること、1 回目接種後よりも 2 回目接種後で発現割合が高い事象が認められて
いることに加え、発現割合の高い事象の発現時期や持続期間等については、医療従事者、被接種者やそ
の保護者等に対して適切に情報提供する必要がある。
7.R.3.2
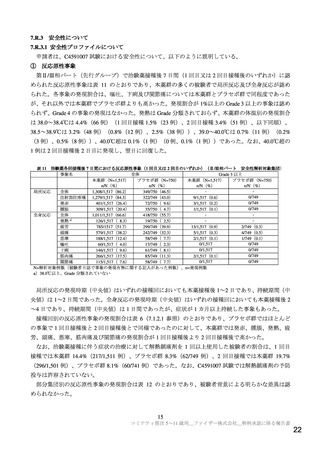
基礎疾患を有する小児における安全性について
申請者は、基礎疾患を有する小児における安全性について、以下のように説明している。
一 部 の 基 礎 疾 患 や 肥 満 を 有 す る 小 児 は COVID-19 の 重 症 化 リ ス ク が 高 い と さ れ て い る
(https://www.cdc.gov/coronavirus/2019-ncov/need-extra-precautions/people-with-medical-conditions.html(最終
確認日:2021 年 12 月 10 日))。C4591007 試験では状態が安定している基礎疾患を有する小児も組入
れ可能であり、COVID-19 の重症化リスク因子として、喘息、血液疾患、心血管疾患、慢性肺疾患、慢性
代謝性疾患、先天性心臓疾患、糖尿病、経管栄養者、免疫不全状態、神経疾患、鎌状赤血球等の基礎疾
患又は肥満18)を定義し、解析を行った。第Ⅱ/Ⅲ相パートの先行グループの安全性解析対象集団のうち、
ベースライン時に COVID-19 の重症化リスク因子(基礎疾患又は肥満)を有していた被験者は、本薬群で
20.6%(312/1,518 例)、プラセボ群で 20.3%(152/750 例)であり、主な基礎疾患又は状態は、肥満(本
治験実施計画書では、14 日以内に非生ワクチン、インフルエンザワクチン若しくはロタウイルスワクチンを接種した被験者、又は
28 日以内にその他の生ワクチン(インフルエンザワクチン及びロタウイルスワクチンを除く)を接種した被験者では、治験薬の接種
を延期することと規定された。
17)
治験薬接種から他の感染症ワクチン接種までの間隔は、本薬群 10~34 日間、プラセボ群 6~42 日間であり、他の感染症ワクチンの
内訳は、ジフテリア・百日咳(無細胞性)・破傷風混合ワクチン(本薬群 5 例、プラセボ群 3 例、以下同順)、ジフテリア・百日咳
(5 成分無細胞性)・破傷風混合ワクチン(0 例、1 例)、ジフテリア・破傷風混合ワクチン(0 例、1 例)、ヒトパピローマウイル
スワクチン(3 例、4 例)、4 価ヒトパピローマウイルス様粒子ワクチン(1 例、1 例)、髄膜炎菌ワクチン(2 例、0 例)、4 価髄膜
炎菌ワクチン(1 例、2 例)、4 価髄膜炎菌ワクチン(ジフテリアトキソイド結合体)(1 例、0 例)、ダニ媒介性脳炎ワクチン(1 例、
0 例)、不活化ダニ媒介性脳炎ワクチン(2 例、0 例)であった。
18)
CDC growth chart(https://www.cdc.gov/growthcharts/html_charts/bmiagerev.htm(最終確認日:2021 年 12 月 10 日))における BMI パー
センタイル値が 95 パーセンタイル以上
16)
17
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
24
(局所反応及び全身反応)が認められたが、ほとんどは軽度又は中等度であり、症状発現後短時間で消
失しており、これまでに 12 歳以上で確認されているプロファイルと同様であった。また、反応原性事象
以外の有害事象の発現割合は低くほとんどは軽度又は中等度であり、本薬との因果関係が否定されない
重篤な有害事象は認められていないこと等から、現時点で 5~11 歳の小児における本薬の安全性に重大
な懸念は認められておらず、忍容性は確認されたと考える。
なお、C4591007 試験において、治験薬と他の感染症予防ワクチンを同時接種された被験者はいなかっ
た16)。治験薬 1 回目接種以降に他の感染症予防ワクチンが接種された被験者は本薬群 10/1,518 例及びプ
ラセボ群 6/750 例17)確認されたが、治験薬最終接種後 1 カ月までの有害事象は本薬群では認められず、
プラセボ群 2 例に認められた。
機構は、以下のように考える。
C4591007 試験において、被験者の多くに反応原性事象(局所反応及び全身反応)が認められたものの、
ほとんどが軽度又は中等度であり回復性が認められていること、反応原性事象以外の有害事象の発現割
合は低くほとんどは軽度又は中等度であること等を確認し、現時点で得られている情報からは、5~11 歳
の小児における本薬の安全性に重大な懸念は認められていないと判断した。ただし、5~11 歳の小児に
おける安全性情報は限られていること等から、製造販売後には当該年齢層の小児における本剤の安全性
について情報収集し、得られた情報に基づき適切に対応する必要がある。また、局所反応や全身反応が
多くの被験者に認められること、1 回目接種後よりも 2 回目接種後で発現割合が高い事象が認められて
いることに加え、発現割合の高い事象の発現時期や持続期間等については、医療従事者、被接種者やそ
の保護者等に対して適切に情報提供する必要がある。
7.R.3.2
基礎疾患を有する小児における安全性について
申請者は、基礎疾患を有する小児における安全性について、以下のように説明している。
一 部 の 基 礎 疾 患 や 肥 満 を 有 す る 小 児 は COVID-19 の 重 症 化 リ ス ク が 高 い と さ れ て い る
(https://www.cdc.gov/coronavirus/2019-ncov/need-extra-precautions/people-with-medical-conditions.html(最終
確認日:2021 年 12 月 10 日))。C4591007 試験では状態が安定している基礎疾患を有する小児も組入
れ可能であり、COVID-19 の重症化リスク因子として、喘息、血液疾患、心血管疾患、慢性肺疾患、慢性
代謝性疾患、先天性心臓疾患、糖尿病、経管栄養者、免疫不全状態、神経疾患、鎌状赤血球等の基礎疾
患又は肥満18)を定義し、解析を行った。第Ⅱ/Ⅲ相パートの先行グループの安全性解析対象集団のうち、
ベースライン時に COVID-19 の重症化リスク因子(基礎疾患又は肥満)を有していた被験者は、本薬群で
20.6%(312/1,518 例)、プラセボ群で 20.3%(152/750 例)であり、主な基礎疾患又は状態は、肥満(本
治験実施計画書では、14 日以内に非生ワクチン、インフルエンザワクチン若しくはロタウイルスワクチンを接種した被験者、又は
28 日以内にその他の生ワクチン(インフルエンザワクチン及びロタウイルスワクチンを除く)を接種した被験者では、治験薬の接種
を延期することと規定された。
17)
治験薬接種から他の感染症ワクチン接種までの間隔は、本薬群 10~34 日間、プラセボ群 6~42 日間であり、他の感染症ワクチンの
内訳は、ジフテリア・百日咳(無細胞性)・破傷風混合ワクチン(本薬群 5 例、プラセボ群 3 例、以下同順)、ジフテリア・百日咳
(5 成分無細胞性)・破傷風混合ワクチン(0 例、1 例)、ジフテリア・破傷風混合ワクチン(0 例、1 例)、ヒトパピローマウイル
スワクチン(3 例、4 例)、4 価ヒトパピローマウイルス様粒子ワクチン(1 例、1 例)、髄膜炎菌ワクチン(2 例、0 例)、4 価髄膜
炎菌ワクチン(1 例、2 例)、4 価髄膜炎菌ワクチン(ジフテリアトキソイド結合体)(1 例、0 例)、ダニ媒介性脳炎ワクチン(1 例、
0 例)、不活化ダニ媒介性脳炎ワクチン(2 例、0 例)であった。
18)
CDC growth chart(https://www.cdc.gov/growthcharts/html_charts/bmiagerev.htm(最終確認日:2021 年 12 月 10 日))における BMI パー
センタイル値が 95 パーセンタイル以上
16)
17
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
24