よむ、つかう、まなぶ。
【資料3-1】新型コロナワクチン(コミナティ筋注5~ 11 歳用)の承認について(医薬・生活衛生局の説明資料) (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
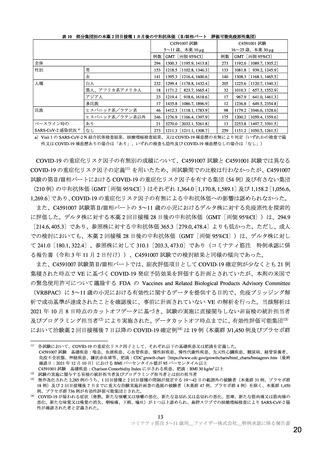
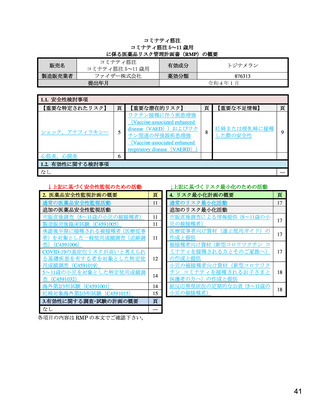
表 12
治験薬各回接種後 7 日間における反応原性事象(1 回目又は 2 回目のいずれか)
部分集団解析(Ⅱ/Ⅲ相パート
全体
性別
人種別
民族別
安全性解析対象集団)
局所反応
全身反応
本薬群
プラセボ群
本薬群
プラセボ群
n/N(%)
n/N(%)
n/N(%)
n/N(%)
1,308/1,517(86.2) 349/750(46.5) 1,011/1,517(66.6)
418/750(55.7)
男
674/799(84.4) 165/383(43.1)
533/799(66.7)
206/383(53.8)
女
634/718(88.3) 184/367(50.1)
478/718(66.6)
212/367(57.8)
白人
1,047/1,204(87.0) 267/586(45.6) 797/1,204(66.2)
320/586(54.6)
黒人、アフリカ系アメリカ人
69/88(78.4)
24/58(41.4)
60/88(68.2)
31/58(53.4)
その他a)
192/225(85.3) 58/106(54.7)
154/225(68.4)
67/106(63.2)
ヒスパニック系/ラテン系
271/318(85.2) 79/159(49.7)
212/318(66.7)
89/159(56.0)
ヒスパニック系/ラテン系以外 1,034/1,196(86.5) 270/591(45.7) 797/1,196(66.6)
591/329(55.7)
0/0
0/0
不明
3/3(100)
2/3(66.7)
あり
112/133(84.2)
22/65(33.8)
81/133(60.9)
28/65(43.1)
なし
1,196/1,384(86.4) 327/685(47.7) 930/1,384(67.2)
390/685(56.9)
ベースライン時の
SARS-CoV-2感染状況b)
肥満 c)
あり
151/173(87.3)
42/92(45.7)
118/173(68.2)
57/92(62.0)
なし
1,157/1,343(86.2) 307/658(46.7) 893/1,343(66.5)
361/658(54.9)
COVID-19の重症化リス あり
269/311(86.5) 69/152(45.4)
211/311(67.8)
85/152(55.9)
ク因子d)
なし
1,039/1,206(86.2) 280/598(46.8) 800/1,206(66.3)
333/598(55.7)
N=解析対象例数、n=発現例数
a)多民族109例、アジア人90例、アメリカ系インディアン又はアラスカ原住民12例、ハワイ原住民又はその他太平洋諸国民5例、不明9例
b)Visit 1のSARS-CoV-2 N結合抗体検査結果、核酸増幅検査結果、又はCOVID-19罹患歴の有無により判定(いずれかの検査で陽性又は
COVID-19罹患歴ありの場合は「あり」、いずれの検査も陰性及びCOVID-19罹患歴なしの場合は「なし」)
c)CDC growth chart(https://www.cdc.gov/growthcharts/html_charts/bmiagerev.htm(最終確認日:2021年12月10日))におけるBMIパーセン
タイル値が95パーセンタイル以上
d)基礎疾患(喘息、血液疾患、心血管疾患、慢性肺疾患、慢性代謝性疾患、先天性心臓疾患、糖尿病、経管栄養者、免疫不全状態、神経
疾患、鎌状赤血球等)又は肥満(注釈c参照)をリスク因子と定義
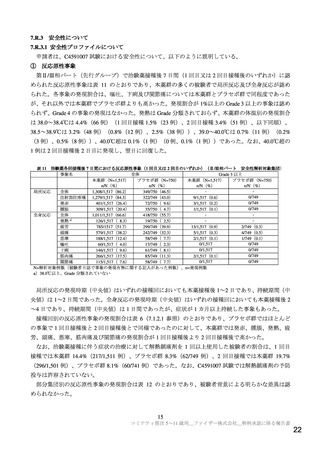
② 有害事象
第Ⅱ/Ⅲ相パート(先行グループ)で治験薬最終接種後 1 カ月までの有害事象(治験薬各回接種後 7 日
間の反応原性事象を除く)の発現割合は、本薬群 10.9%(166/1,518 例)、プラセボ群 9.2%(69/750 例)
であり、発現割合 1%以上の事象は認められず、本薬群で最も発現割合が高かった事象はリンパ節症 0.9%
(13/1,518 例)であった(7.1.2.1、表 7 参照)。
追加グループにおいて、データカットオフ日(2021 年 10 月 8 日)までに認められた有害事象の発現
割合は本薬群 7.2%(115/1,591 例)、プラセボ群 6.3%(50/788 例)であった(治験薬 2 回目接種後の観
察期間は 2.4 週(中央値))。本薬群で発現割合 1%以上であった事象は注射部位疼痛 1.1%(18/1,591 例)
であり(7.1.2.2、表 8 参照)、有害事象の発現状況は先行グループと概ね同様であった。
いずれのグループでもアナフィラキシー、心筋炎、心膜炎及びベル麻痺の報告はなかった。また、重
症 COVID-19 の報告はなく、VAED/VAERD を示唆するエビデンスは得られなかった。
③ 重篤な有害事象
第Ⅰ相パート(データカットオフ日 2021 年 7 月 16 日)で重篤な有害事象は認められなかった。
第Ⅱ/Ⅲ相パートの本薬群で認められた重篤な有害事象は、先行グループ(データカットオフ日 2021
年 9 月 6 日)で 1 例(上肢骨折)、追加グループ(データカットオフ日 2021 年 10 月 8 日)で 3 例(感
染性関節炎、異物誤飲及び骨端骨折各 1 例)に認められたが、いずれも本薬との因果関係は否定され、
転帰は回復又は軽快であった。
いずれのパートでも死亡例は認められていない。
16
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
23
治験薬各回接種後 7 日間における反応原性事象(1 回目又は 2 回目のいずれか)
部分集団解析(Ⅱ/Ⅲ相パート
全体
性別
人種別
民族別
安全性解析対象集団)
局所反応
全身反応
本薬群
プラセボ群
本薬群
プラセボ群
n/N(%)
n/N(%)
n/N(%)
n/N(%)
1,308/1,517(86.2) 349/750(46.5) 1,011/1,517(66.6)
418/750(55.7)
男
674/799(84.4) 165/383(43.1)
533/799(66.7)
206/383(53.8)
女
634/718(88.3) 184/367(50.1)
478/718(66.6)
212/367(57.8)
白人
1,047/1,204(87.0) 267/586(45.6) 797/1,204(66.2)
320/586(54.6)
黒人、アフリカ系アメリカ人
69/88(78.4)
24/58(41.4)
60/88(68.2)
31/58(53.4)
その他a)
192/225(85.3) 58/106(54.7)
154/225(68.4)
67/106(63.2)
ヒスパニック系/ラテン系
271/318(85.2) 79/159(49.7)
212/318(66.7)
89/159(56.0)
ヒスパニック系/ラテン系以外 1,034/1,196(86.5) 270/591(45.7) 797/1,196(66.6)
591/329(55.7)
0/0
0/0
不明
3/3(100)
2/3(66.7)
あり
112/133(84.2)
22/65(33.8)
81/133(60.9)
28/65(43.1)
なし
1,196/1,384(86.4) 327/685(47.7) 930/1,384(67.2)
390/685(56.9)
ベースライン時の
SARS-CoV-2感染状況b)
肥満 c)
あり
151/173(87.3)
42/92(45.7)
118/173(68.2)
57/92(62.0)
なし
1,157/1,343(86.2) 307/658(46.7) 893/1,343(66.5)
361/658(54.9)
COVID-19の重症化リス あり
269/311(86.5) 69/152(45.4)
211/311(67.8)
85/152(55.9)
ク因子d)
なし
1,039/1,206(86.2) 280/598(46.8) 800/1,206(66.3)
333/598(55.7)
N=解析対象例数、n=発現例数
a)多民族109例、アジア人90例、アメリカ系インディアン又はアラスカ原住民12例、ハワイ原住民又はその他太平洋諸国民5例、不明9例
b)Visit 1のSARS-CoV-2 N結合抗体検査結果、核酸増幅検査結果、又はCOVID-19罹患歴の有無により判定(いずれかの検査で陽性又は
COVID-19罹患歴ありの場合は「あり」、いずれの検査も陰性及びCOVID-19罹患歴なしの場合は「なし」)
c)CDC growth chart(https://www.cdc.gov/growthcharts/html_charts/bmiagerev.htm(最終確認日:2021年12月10日))におけるBMIパーセン
タイル値が95パーセンタイル以上
d)基礎疾患(喘息、血液疾患、心血管疾患、慢性肺疾患、慢性代謝性疾患、先天性心臓疾患、糖尿病、経管栄養者、免疫不全状態、神経
疾患、鎌状赤血球等)又は肥満(注釈c参照)をリスク因子と定義
② 有害事象
第Ⅱ/Ⅲ相パート(先行グループ)で治験薬最終接種後 1 カ月までの有害事象(治験薬各回接種後 7 日
間の反応原性事象を除く)の発現割合は、本薬群 10.9%(166/1,518 例)、プラセボ群 9.2%(69/750 例)
であり、発現割合 1%以上の事象は認められず、本薬群で最も発現割合が高かった事象はリンパ節症 0.9%
(13/1,518 例)であった(7.1.2.1、表 7 参照)。
追加グループにおいて、データカットオフ日(2021 年 10 月 8 日)までに認められた有害事象の発現
割合は本薬群 7.2%(115/1,591 例)、プラセボ群 6.3%(50/788 例)であった(治験薬 2 回目接種後の観
察期間は 2.4 週(中央値))。本薬群で発現割合 1%以上であった事象は注射部位疼痛 1.1%(18/1,591 例)
であり(7.1.2.2、表 8 参照)、有害事象の発現状況は先行グループと概ね同様であった。
いずれのグループでもアナフィラキシー、心筋炎、心膜炎及びベル麻痺の報告はなかった。また、重
症 COVID-19 の報告はなく、VAED/VAERD を示唆するエビデンスは得られなかった。
③ 重篤な有害事象
第Ⅰ相パート(データカットオフ日 2021 年 7 月 16 日)で重篤な有害事象は認められなかった。
第Ⅱ/Ⅲ相パートの本薬群で認められた重篤な有害事象は、先行グループ(データカットオフ日 2021
年 9 月 6 日)で 1 例(上肢骨折)、追加グループ(データカットオフ日 2021 年 10 月 8 日)で 3 例(感
染性関節炎、異物誤飲及び骨端骨折各 1 例)に認められたが、いずれも本薬との因果関係は否定され、
転帰は回復又は軽快であった。
いずれのパートでも死亡例は認められていない。
16
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
23