よむ、つかう、まなぶ。
【資料3-1】新型コロナワクチン(コミナティ筋注5~ 11 歳用)の承認について(医薬・生活衛生局の説明資料) (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
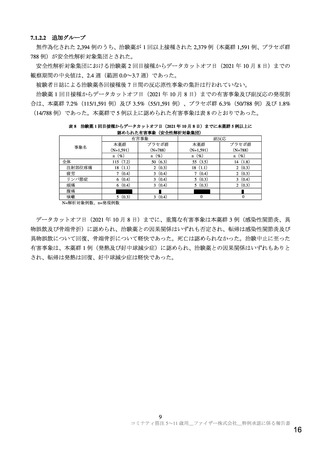
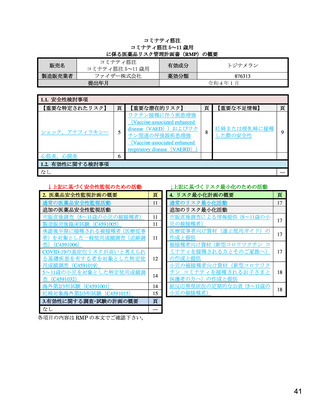
表2
治験薬各回接種後 7 日間における反応原性事象(安全性解析対象集団)
用量
30 µg 群
30 µg 群
10 µg 群
20 µg 群
接種回
(2 回目 30 µg)
(2 回目 10 µg)
(N=16)
(N=16)
(N=4)
(N=12)
n(%)
n(%)
n(%)
n(%)
事象名
局所反応
1 回目
2 回目
1 回目
2 回目
1 回目
2 回目
注射部位疼痛
発赤
腫脹
14(87.5)
14(87.5)
2(12.5)
6(37.5)
3(18.8)
5(31.3)
15(93.8)
12(75.0)
0
3(18.8)
1( 6.3)
3(18.8)
4(100)
4(100)
4(100)
3(75.0)
2(50.0)
2(50.0)
10(83.3)
11(91.7)
2(16.7)
2(16.7)
1( 8.3)
0
1( 6.3)
2(12.5)
8(50.0)
11(68.8)
4(25.0)
8(50.0)
0
5(31.3)
0
0
1( 6.3)
1( 6.3)
2(12.5)
0
1(6.3)
0
1( 6.3)
3(18.8)
11(68.8)
10(62.5)
5(31.3)
9(56.3)
4(25.0)
7(43.8)
1( 6.3)
0
1( 6.3)
0
4(25.0)
3(18.8)
1( 6.3)
0
0
4(100)
4(100)
4(100)
3(75.0)
3(75.0)
2(50.0)
3(75.0)
0
1(25.0)
0
2(50.0)
4(100)
2(50.0)
1(25.0)
1(25.0)
4(33.3)
0
6(50.0)
9(75.0)
4(33.3)
4(33.3)
2(16.7)
4(33.3)
1( 8.3)
1( 8.3)
0
0
0
1( 8.3)
1( 8.3)
0
全身反応
1 回目
2 回目
1 回目
疲労
2 回目
1 回目
頭痛
2 回目
1 回目
悪寒
2 回目
1 回目
嘔吐
2 回目
1 回目
下痢
2 回目
1 回目
筋肉痛
2 回目
1 回目
関節痛
2 回目
N=解析対象例数、n=発現例数
発熱
また、治験薬最終接種後 1 カ月までの有害事象及び副反応(治験薬との因果関係が否定されない有害
事象、以下同様)の発現割合は、表 3 のとおりであった。合計 2 例以上に認められた有害事象は、反応
原性事象として収集されている事象である注射部位疼痛(10 µg 群 1 例及び 30 µg 群(2 回目 10 µg)2
例)及び関節痛(10 µg 群及び 30 µg 群(2 回目 30 µg)各 1 例)の他、リンパ節症(20 µg 群及び 30 µg
群(2 回目 30 µg)各 1 例)及び蟯虫症(20 µg 群 2 例)であった。リンパ節症及び蟯虫症のうち、本薬
との因果関係が否定されなかった事象は、リンパ節症 1 例(30 µg 群)であり、転帰は回復であった。
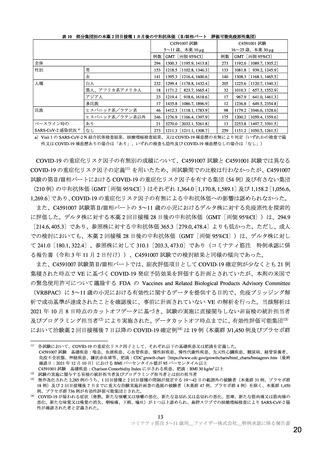
表3
治験薬最終接種後 1 カ月までの有害事象及び副反応(安全性解析対象集団)
用量
30 µg 群
30 µg 群
10 µg 群
20 µg 群
(2 回目 30 µg)
(2 回目 10 µg)
(N=16)
(N=16)
(N=4)
(N=12)
n(%)
n(%)
n(%)
n(%)
有害事象
7(43.8)
5(31.3)
2(50.0)
3(25.0)
副反応
4(25.0)
2(12.5)
2(50.0)
3(25.0)
N=解析対象例数、n=発現例数
データカットオフ日(2021 年 7 月 16 日)までに死亡例、重篤な有害事象及び治験中止に至った有害
事象は認められなかった。
免疫原性について、評価可能免疫原性集団における治験薬 2 回目接種 7 日後の GMT[両側 95%CI]
は、10 µg 群で 4,162.6[2,584.7, 6,704.0]、20 µg 群で 4,583.4[2,802.9, 7,494.8]であった。
5
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
12
治験薬各回接種後 7 日間における反応原性事象(安全性解析対象集団)
用量
30 µg 群
30 µg 群
10 µg 群
20 µg 群
接種回
(2 回目 30 µg)
(2 回目 10 µg)
(N=16)
(N=16)
(N=4)
(N=12)
n(%)
n(%)
n(%)
n(%)
事象名
局所反応
1 回目
2 回目
1 回目
2 回目
1 回目
2 回目
注射部位疼痛
発赤
腫脹
14(87.5)
14(87.5)
2(12.5)
6(37.5)
3(18.8)
5(31.3)
15(93.8)
12(75.0)
0
3(18.8)
1( 6.3)
3(18.8)
4(100)
4(100)
4(100)
3(75.0)
2(50.0)
2(50.0)
10(83.3)
11(91.7)
2(16.7)
2(16.7)
1( 8.3)
0
1( 6.3)
2(12.5)
8(50.0)
11(68.8)
4(25.0)
8(50.0)
0
5(31.3)
0
0
1( 6.3)
1( 6.3)
2(12.5)
0
1(6.3)
0
1( 6.3)
3(18.8)
11(68.8)
10(62.5)
5(31.3)
9(56.3)
4(25.0)
7(43.8)
1( 6.3)
0
1( 6.3)
0
4(25.0)
3(18.8)
1( 6.3)
0
0
4(100)
4(100)
4(100)
3(75.0)
3(75.0)
2(50.0)
3(75.0)
0
1(25.0)
0
2(50.0)
4(100)
2(50.0)
1(25.0)
1(25.0)
4(33.3)
0
6(50.0)
9(75.0)
4(33.3)
4(33.3)
2(16.7)
4(33.3)
1( 8.3)
1( 8.3)
0
0
0
1( 8.3)
1( 8.3)
0
全身反応
1 回目
2 回目
1 回目
疲労
2 回目
1 回目
頭痛
2 回目
1 回目
悪寒
2 回目
1 回目
嘔吐
2 回目
1 回目
下痢
2 回目
1 回目
筋肉痛
2 回目
1 回目
関節痛
2 回目
N=解析対象例数、n=発現例数
発熱
また、治験薬最終接種後 1 カ月までの有害事象及び副反応(治験薬との因果関係が否定されない有害
事象、以下同様)の発現割合は、表 3 のとおりであった。合計 2 例以上に認められた有害事象は、反応
原性事象として収集されている事象である注射部位疼痛(10 µg 群 1 例及び 30 µg 群(2 回目 10 µg)2
例)及び関節痛(10 µg 群及び 30 µg 群(2 回目 30 µg)各 1 例)の他、リンパ節症(20 µg 群及び 30 µg
群(2 回目 30 µg)各 1 例)及び蟯虫症(20 µg 群 2 例)であった。リンパ節症及び蟯虫症のうち、本薬
との因果関係が否定されなかった事象は、リンパ節症 1 例(30 µg 群)であり、転帰は回復であった。
表3
治験薬最終接種後 1 カ月までの有害事象及び副反応(安全性解析対象集団)
用量
30 µg 群
30 µg 群
10 µg 群
20 µg 群
(2 回目 30 µg)
(2 回目 10 µg)
(N=16)
(N=16)
(N=4)
(N=12)
n(%)
n(%)
n(%)
n(%)
有害事象
7(43.8)
5(31.3)
2(50.0)
3(25.0)
副反応
4(25.0)
2(12.5)
2(50.0)
3(25.0)
N=解析対象例数、n=発現例数
データカットオフ日(2021 年 7 月 16 日)までに死亡例、重篤な有害事象及び治験中止に至った有害
事象は認められなかった。
免疫原性について、評価可能免疫原性集団における治験薬 2 回目接種 7 日後の GMT[両側 95%CI]
は、10 µg 群で 4,162.6[2,584.7, 6,704.0]、20 µg 群で 4,583.4[2,802.9, 7,494.8]であった。
5
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
12