よむ、つかう、まなぶ。
【資料3-1】新型コロナワクチン(コミナティ筋注5~ 11 歳用)の承認について(医薬・生活衛生局の説明資料) (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
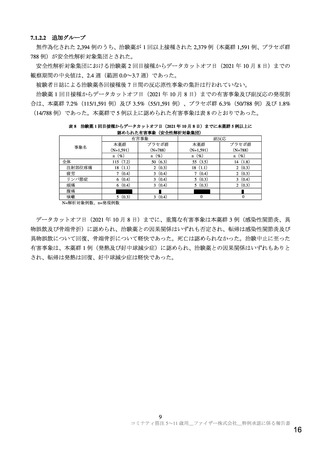
起原又は発見の経緯及び外国における使用状況に関する資料等
1.
本薬は、SARS-CoV-2 のスパイクタンパク質をコードする mRNA を有効成分とするワクチンであり、
本邦では、本薬を含有する「コミナティ筋注」が「SARS-CoV-2 による感染症の予防」の効能・効果で、
2021 年 2 月に製造販売承認された。本邦では 12 歳以上を対象に「コミナティ筋注」を含む SARS-CoV2 ワクチン接種が進められ、2021 年 12 月 10 日時点で全国民の 7 割以上が SARS-CoV-2 ワクチンの 2
回接種を完了しており(https://www.kantei.go.jp/jp/headline/kansensho/vaccine.html(最終確認日:2021 年
12 月 10 日))、本邦の SARS-CoV-2 新規陽性者数は低値で推移している(https://www.mhlw.go.jp/stf/covid19/kokunainohasseijoukyou.html(最終確認日:2021 年 12 月 10 日))。
小児の COVID-19 は比較的軽症で、重症化することはまれとされているが(https://www.who.int/public
ations/i/item/WHO-2019-nCoV-Sci_Brief-Children_and_adolescents-2021.1(最終確認日:2021 年 12 月 10
日))、入院治療等を要する症例も一定数報告されている(J Pediatric Infect Dis Soc. 2021 Sep 6;piab
085. doi: 10.1093/jpids/piab085)。また、SARS-CoV-2 に感染した一部の小児において、発熱や多臓器障
害を伴う MIS-C/PIMS(小児多系統炎症性症候群)が報告されており(「小児 COVID-19 関連多系統炎
症性症候群(MIS-C/PIMS)診療コンセンサスステートメント」http://www.jpeds.or.jp/uploads/files/202109
16_mis-c_c_s.pdf(最終確認日:2021 年 12 月 10 日))、海外では死亡例も報告されている(JAMA Pe
diatr 2021; 175: 837-45)。
本剤の開発に際し、申請者は小児を対象とした海外第Ⅰ/Ⅱ/Ⅲ相試験(C4591007 試験)を実施した。
当該試験において、5~11 歳の小児における免疫原性及び安全性が確認されたことを根拠として、2021
年 10 月 29 日に米国で 5~11 歳の小児に対する本剤の緊急使用許可がなされ、同年 12 月 8 日時点で米
国、欧州等 15 の国又は地域で製造販売承認又は使用許可がなされている。
今般、本邦においても、当該試験を根拠として、5~11 歳の小児に係る用法・用量の追加及び 5~11 歳
用の製剤として本剤の剤形追加に係る製造販売承認申請が行われた。
本審査は、「特例承認の申請がなされている医薬品の取扱いについて(依頼)」(令和 3 年 11 月 25
日付け薬生薬審発 1125 第 14 号)を踏まえ、申請者から提出された資料に基づき審査を行ったものであ
る。
品質に関する資料及び機構における審査の概略
2.
本申請は新用量に係る申請に合わせ、接種対象者に対して新たな製剤が使用されることから、剤形追
加に係る医薬品としても申請され、品質に係る資料等が提出されている。
2.R
機構における審査の概略
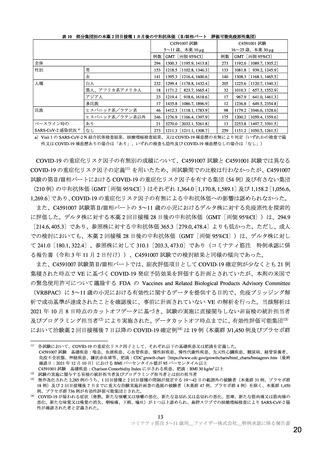
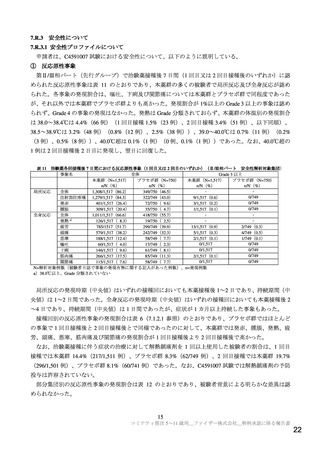
本剤は、1 バイアル(1.3 mL)あたりトジナメラン 0.130 mg を含有する複数回接種用のバイアルであ
る。本剤は、既承認製剤(コミナティ筋注)と有効成分含量及び濃度、脂質含量及び濃度、並びに添加
剤成分が異なる。提出された資料に基づき審査を行った結果、本剤の品質に関して特段の問題は認めら
れなかった。なお、有効期間の設定については検討中であり、報告(2)に記載する。
2.R.1
1 バイアルからの採取可能な回数について
申請者は、本剤 1 バイアルから採取可能な回数について、以下のように説明している。
本剤は、表示容量 1.3 mL に対し、生理食塩水 1.3 mL で希釈し、1 接種あたり 0.2 mL を使用する製剤
である。採取容量試験及び理論的評価により、デッドボリュームが少ない注射シリンジ及び注射針を用
2
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
9
1.
本薬は、SARS-CoV-2 のスパイクタンパク質をコードする mRNA を有効成分とするワクチンであり、
本邦では、本薬を含有する「コミナティ筋注」が「SARS-CoV-2 による感染症の予防」の効能・効果で、
2021 年 2 月に製造販売承認された。本邦では 12 歳以上を対象に「コミナティ筋注」を含む SARS-CoV2 ワクチン接種が進められ、2021 年 12 月 10 日時点で全国民の 7 割以上が SARS-CoV-2 ワクチンの 2
回接種を完了しており(https://www.kantei.go.jp/jp/headline/kansensho/vaccine.html(最終確認日:2021 年
12 月 10 日))、本邦の SARS-CoV-2 新規陽性者数は低値で推移している(https://www.mhlw.go.jp/stf/covid19/kokunainohasseijoukyou.html(最終確認日:2021 年 12 月 10 日))。
小児の COVID-19 は比較的軽症で、重症化することはまれとされているが(https://www.who.int/public
ations/i/item/WHO-2019-nCoV-Sci_Brief-Children_and_adolescents-2021.1(最終確認日:2021 年 12 月 10
日))、入院治療等を要する症例も一定数報告されている(J Pediatric Infect Dis Soc. 2021 Sep 6;piab
085. doi: 10.1093/jpids/piab085)。また、SARS-CoV-2 に感染した一部の小児において、発熱や多臓器障
害を伴う MIS-C/PIMS(小児多系統炎症性症候群)が報告されており(「小児 COVID-19 関連多系統炎
症性症候群(MIS-C/PIMS)診療コンセンサスステートメント」http://www.jpeds.or.jp/uploads/files/202109
16_mis-c_c_s.pdf(最終確認日:2021 年 12 月 10 日))、海外では死亡例も報告されている(JAMA Pe
diatr 2021; 175: 837-45)。
本剤の開発に際し、申請者は小児を対象とした海外第Ⅰ/Ⅱ/Ⅲ相試験(C4591007 試験)を実施した。
当該試験において、5~11 歳の小児における免疫原性及び安全性が確認されたことを根拠として、2021
年 10 月 29 日に米国で 5~11 歳の小児に対する本剤の緊急使用許可がなされ、同年 12 月 8 日時点で米
国、欧州等 15 の国又は地域で製造販売承認又は使用許可がなされている。
今般、本邦においても、当該試験を根拠として、5~11 歳の小児に係る用法・用量の追加及び 5~11 歳
用の製剤として本剤の剤形追加に係る製造販売承認申請が行われた。
本審査は、「特例承認の申請がなされている医薬品の取扱いについて(依頼)」(令和 3 年 11 月 25
日付け薬生薬審発 1125 第 14 号)を踏まえ、申請者から提出された資料に基づき審査を行ったものであ
る。
品質に関する資料及び機構における審査の概略
2.
本申請は新用量に係る申請に合わせ、接種対象者に対して新たな製剤が使用されることから、剤形追
加に係る医薬品としても申請され、品質に係る資料等が提出されている。
2.R
機構における審査の概略
本剤は、1 バイアル(1.3 mL)あたりトジナメラン 0.130 mg を含有する複数回接種用のバイアルであ
る。本剤は、既承認製剤(コミナティ筋注)と有効成分含量及び濃度、脂質含量及び濃度、並びに添加
剤成分が異なる。提出された資料に基づき審査を行った結果、本剤の品質に関して特段の問題は認めら
れなかった。なお、有効期間の設定については検討中であり、報告(2)に記載する。
2.R.1
1 バイアルからの採取可能な回数について
申請者は、本剤 1 バイアルから採取可能な回数について、以下のように説明している。
本剤は、表示容量 1.3 mL に対し、生理食塩水 1.3 mL で希釈し、1 接種あたり 0.2 mL を使用する製剤
である。採取容量試験及び理論的評価により、デッドボリュームが少ない注射シリンジ及び注射針を用
2
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
9