よむ、つかう、まなぶ。
【資料3-1】新型コロナワクチン(コミナティ筋注5~ 11 歳用)の承認について(医薬・生活衛生局の説明資料) (46 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
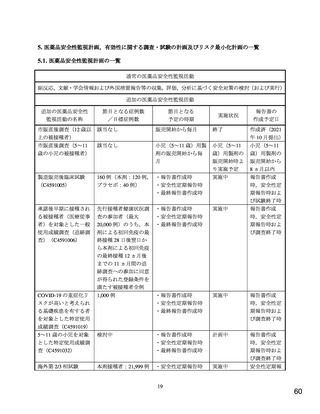
1. 医薬品リスク管理計画の概要
1.1. 安全性検討事項
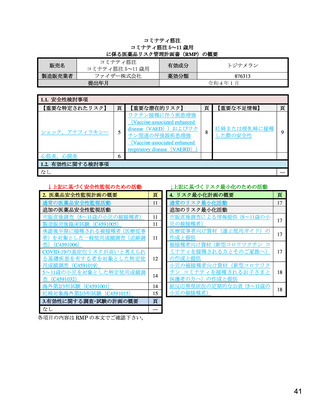
重要な特定されたリスク
ショック,アナフィラキシー
重要な特定されたリスクとした理由:
海外において初めて緊急供給の仮承認を取得した 2020 年 12 月 1 日以降,2020 年 12 月 31 日まで
の間にアナフィラキシー関連事象(MedDRA SMQ アナフィラキシー反応(狭域および広域))
として 824 例 1245 件が報告され,このうち 314 件が重篤であった*。また,MedDRA SMQ アナ
フィラキシー反応(狭域)に該当する事象は 43 例 43 件報告され,アナフィラキシー反応 32 件,
アナフィラキシー様反応 5 件,アナフィラキシーショック 4 件,循環虚脱およびショック症状各
1 件であった*。43 例中 13 例は喘息,アナフィラキシーまたは過敏症の既往を有していた。
製造販売後の使用経験において重篤なアナフィラキシー,アナフィラキシーショックが報告され
ていることおよびショック,アナフィラキシーは生命を脅かす可能性があり,医学的介入が必要
となることから重要な特定されたリスクとした。
*推定出荷数量(2020 年 12 月 1 日~2020 年 12 月 31 日):約 26,079,300 回接種分
医薬品安全性監視活動の内容及びその選択理由:
【内容】
通常の医薬品安全性監視活動
追加の医薬品安全性監視活動として,以下を実施する。
1. 使用成績調査(特定使用成績調査)(C4591019 および C4591032)
【選択理由】
通常の医薬品安全性監視活動により,アナフィラキシーの発現状況に関する情報を幅広く収
集するため。
使用成績調査において情報収集を行うため。
リスク最小化活動の内容及びその選択理由:
【内容】
通常のリスク最小化活動として,添付文書の「2.接種不適当者」,「8.重要な基本的注意」,
「9.1 接種要注意者」,「11.1 重大な副反応」の項およびワクチン接種を受ける人へのガイ
ドに記載し注意喚起する。
追加のリスク最小化活動として,以下を実施する。
1. 医療従事者向け資材(適正使用ガイド)の作成と提供
2. 被接種者向け資材(新型コロナワクチン コミナティを接種される方とそのご家族へ)
の作成と提供
3. 小児の被接種者向け資材(新型コロナワクチン コミナティを接種されるお子さまと保
護者の方へ)の作成と提供
【選択理由】
医療機関に対し確実に情報提供を行い,適正な使用に関する理解を促すため。
本リスクに関する情報を医療従事者向け資材(適正使用ガイド),被接種者向け資材(新型
コロナワクチン コミナティを接種される方とそのご家族へ)および小児の被接種者向け資
材(新型コロナワクチン コミナティを接種されるお子さまと保護者の方へ)で提供し,本
5
46
1.1. 安全性検討事項
重要な特定されたリスク
ショック,アナフィラキシー
重要な特定されたリスクとした理由:
海外において初めて緊急供給の仮承認を取得した 2020 年 12 月 1 日以降,2020 年 12 月 31 日まで
の間にアナフィラキシー関連事象(MedDRA SMQ アナフィラキシー反応(狭域および広域))
として 824 例 1245 件が報告され,このうち 314 件が重篤であった*。また,MedDRA SMQ アナ
フィラキシー反応(狭域)に該当する事象は 43 例 43 件報告され,アナフィラキシー反応 32 件,
アナフィラキシー様反応 5 件,アナフィラキシーショック 4 件,循環虚脱およびショック症状各
1 件であった*。43 例中 13 例は喘息,アナフィラキシーまたは過敏症の既往を有していた。
製造販売後の使用経験において重篤なアナフィラキシー,アナフィラキシーショックが報告され
ていることおよびショック,アナフィラキシーは生命を脅かす可能性があり,医学的介入が必要
となることから重要な特定されたリスクとした。
*推定出荷数量(2020 年 12 月 1 日~2020 年 12 月 31 日):約 26,079,300 回接種分
医薬品安全性監視活動の内容及びその選択理由:
【内容】
通常の医薬品安全性監視活動
追加の医薬品安全性監視活動として,以下を実施する。
1. 使用成績調査(特定使用成績調査)(C4591019 および C4591032)
【選択理由】
通常の医薬品安全性監視活動により,アナフィラキシーの発現状況に関する情報を幅広く収
集するため。
使用成績調査において情報収集を行うため。
リスク最小化活動の内容及びその選択理由:
【内容】
通常のリスク最小化活動として,添付文書の「2.接種不適当者」,「8.重要な基本的注意」,
「9.1 接種要注意者」,「11.1 重大な副反応」の項およびワクチン接種を受ける人へのガイ
ドに記載し注意喚起する。
追加のリスク最小化活動として,以下を実施する。
1. 医療従事者向け資材(適正使用ガイド)の作成と提供
2. 被接種者向け資材(新型コロナワクチン コミナティを接種される方とそのご家族へ)
の作成と提供
3. 小児の被接種者向け資材(新型コロナワクチン コミナティを接種されるお子さまと保
護者の方へ)の作成と提供
【選択理由】
医療機関に対し確実に情報提供を行い,適正な使用に関する理解を促すため。
本リスクに関する情報を医療従事者向け資材(適正使用ガイド),被接種者向け資材(新型
コロナワクチン コミナティを接種される方とそのご家族へ)および小児の被接種者向け資
材(新型コロナワクチン コミナティを接種されるお子さまと保護者の方へ)で提供し,本
5
46