よむ、つかう、まなぶ。
【資料3-1】新型コロナワクチン(コミナティ筋注5~ 11 歳用)の承認について(医薬・生活衛生局の説明資料) (56 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
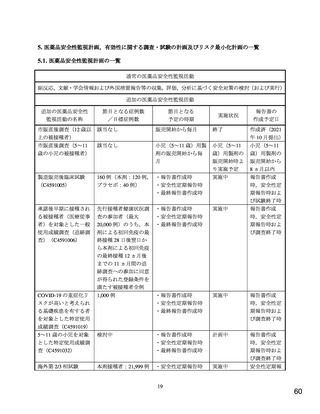
また,追加免疫を受けた被験者における追加接種時および接種後の安全性情報を収集する。
【実施計画概要】
全被験者を対象に重症度に関する情報を含む COVID-19 の発症について追跡調査し,SARS-CoV-2
抗原に特異的な抗体および SARS-CoV-2 中和抗体価測定用に採血する。被験者に COVID-19 を疑
う症状が発現した場合,COVID-19 発症およびその後の回復期に来院する。これらの来院時に抗原
抗体測定用の検体[鼻部(鼻孔)スワブおよび血液]を採取し,COVID-19 関連の臨床および臨床
検査情報(医療機関における診断を含む)を記録する。非盲検のモニターを含む DMC(Data
Monitoring Committee)をサポートする非盲検チームが重症 COVID-19 症例のデータ受領時に重症
症例をレビューし,COVID-19 の潜在的な症例に関する有害事象を少なくとも週 1 回確認する。
また,追加免疫を受けた被験者を対象に追加接種後 1 ヵ月間の有害事象と追加接種後 6 ヵ月間の
重篤な有害事象を収集する。
【目標症例数】
本剤接種者:21,999 例,プラセボ:本剤接種者と同数
[12 歳から 15 歳の年齢層,約 2,000 例(本剤接種群として 1,000 例)を別途追加]
【節目となる予定の時期及びその根拠】
安全性定期報告時および試験終了時に安全性の検討および報告を行う。
【当該医薬品安全性監視活動の結果に基づいて実施される可能性のある追加の措置及びその開始
の決定基準】
本試験の結果を踏まえ,新たな安全性にかかわる懸念等が確認された場合または安全性検討事項
に対するリスクが明らかになった場合,医薬品リスク管理計画書の見直しを行い,更なる検討が必
要と判断する場合には,追加の医薬品安全性監視活動またはリスク最小化策の実施要否を検討す
る。
妊婦対象海外第 2/3 相試験(C4591015)
【安全性検討事項】
心筋炎,心膜炎
妊婦または授乳婦に接種した際の安全性
【目的】
18 歳以上の健康な妊婦を対象として,本剤の安全性,忍容性および免疫原性を評価する。
【実施計画概要】
本試験は,国際共同第 2/3 相,プラセボ対照,無作為化,観察者盲検試験(C4591015 試験)であ
り,妊娠 24-34 週に本剤またはプラセボを接種した約 700 例の 18 歳以上の健康な妊婦における安
全性,忍容性,免疫原性を評価する。被験者は本剤群またはプラセボ群に 1:1 で無作為に割り付け
る。
第 2 相パートには約 200 例の妊婦を組み入れ,妊娠 27-34 週時に本剤群またはプラセボ群に 1:1 で
無作為に割り付ける。独立評価委員会(IRC:Independent Review Committee)は第 2 相パートの被
験者全員の 2 回目接種後 7 日までの安全性データを評価する。
第 3 相パートには約 500 例の妊娠 24-34 週の妊婦を組み入れ,本剤群またはプラセボ群に 1:1 で無
作為に割り付け,本剤の安全性,忍容性および免疫原性を評価する。第 3 相パートは,最初の 200
例が第 2 相パートに組み入れられた後に実施する。
【目標症例数】
第 2 相パートは約 200 例,第 3 相パートは約 500 例の健康な妊婦を登録する。
【節目となる予定の時期及びその根拠】
15
56
【実施計画概要】
全被験者を対象に重症度に関する情報を含む COVID-19 の発症について追跡調査し,SARS-CoV-2
抗原に特異的な抗体および SARS-CoV-2 中和抗体価測定用に採血する。被験者に COVID-19 を疑
う症状が発現した場合,COVID-19 発症およびその後の回復期に来院する。これらの来院時に抗原
抗体測定用の検体[鼻部(鼻孔)スワブおよび血液]を採取し,COVID-19 関連の臨床および臨床
検査情報(医療機関における診断を含む)を記録する。非盲検のモニターを含む DMC(Data
Monitoring Committee)をサポートする非盲検チームが重症 COVID-19 症例のデータ受領時に重症
症例をレビューし,COVID-19 の潜在的な症例に関する有害事象を少なくとも週 1 回確認する。
また,追加免疫を受けた被験者を対象に追加接種後 1 ヵ月間の有害事象と追加接種後 6 ヵ月間の
重篤な有害事象を収集する。
【目標症例数】
本剤接種者:21,999 例,プラセボ:本剤接種者と同数
[12 歳から 15 歳の年齢層,約 2,000 例(本剤接種群として 1,000 例)を別途追加]
【節目となる予定の時期及びその根拠】
安全性定期報告時および試験終了時に安全性の検討および報告を行う。
【当該医薬品安全性監視活動の結果に基づいて実施される可能性のある追加の措置及びその開始
の決定基準】
本試験の結果を踏まえ,新たな安全性にかかわる懸念等が確認された場合または安全性検討事項
に対するリスクが明らかになった場合,医薬品リスク管理計画書の見直しを行い,更なる検討が必
要と判断する場合には,追加の医薬品安全性監視活動またはリスク最小化策の実施要否を検討す
る。
妊婦対象海外第 2/3 相試験(C4591015)
【安全性検討事項】
心筋炎,心膜炎
妊婦または授乳婦に接種した際の安全性
【目的】
18 歳以上の健康な妊婦を対象として,本剤の安全性,忍容性および免疫原性を評価する。
【実施計画概要】
本試験は,国際共同第 2/3 相,プラセボ対照,無作為化,観察者盲検試験(C4591015 試験)であ
り,妊娠 24-34 週に本剤またはプラセボを接種した約 700 例の 18 歳以上の健康な妊婦における安
全性,忍容性,免疫原性を評価する。被験者は本剤群またはプラセボ群に 1:1 で無作為に割り付け
る。
第 2 相パートには約 200 例の妊婦を組み入れ,妊娠 27-34 週時に本剤群またはプラセボ群に 1:1 で
無作為に割り付ける。独立評価委員会(IRC:Independent Review Committee)は第 2 相パートの被
験者全員の 2 回目接種後 7 日までの安全性データを評価する。
第 3 相パートには約 500 例の妊娠 24-34 週の妊婦を組み入れ,本剤群またはプラセボ群に 1:1 で無
作為に割り付け,本剤の安全性,忍容性および免疫原性を評価する。第 3 相パートは,最初の 200
例が第 2 相パートに組み入れられた後に実施する。
【目標症例数】
第 2 相パートは約 200 例,第 3 相パートは約 500 例の健康な妊婦を登録する。
【節目となる予定の時期及びその根拠】
15
56