よむ、つかう、まなぶ。
【資料3-1】新型コロナワクチン(コミナティ筋注5~ 11 歳用)の承認について(医薬・生活衛生局の説明資料) (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
7.1.2
第Ⅱ/Ⅲ相パート
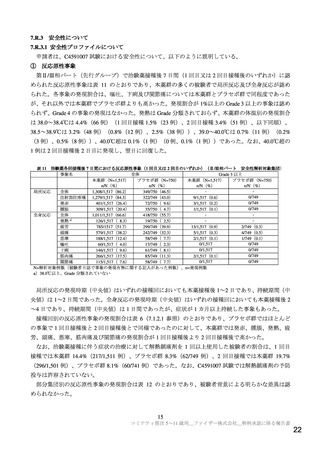
5~11 歳の健康小児(状態が安定している基礎疾患を有する小児を含む)における本薬の免疫原性、
安全性及び忍容性を検討することを目的とした多施設共同無作為化観察者盲検プラセボ対照並行群間比
較試験が海外 4 カ国(米国、フィンランド、ポーランド及びスペイン)81 施設で実施された。被験者、
治験責任医師、治験実施施設のスタッフ(治験薬調製者及び接種者を除く)及び治験依頼者(事前規定
された本試験からは独立した一部のスタッフを除く)は盲検とされた。
用法・用量は、治験薬(本薬 10 µg 又はプラセボ)を 21 日間隔で 2 回(Day 1 及び Day 19~23)、筋
肉内接種することとされた。
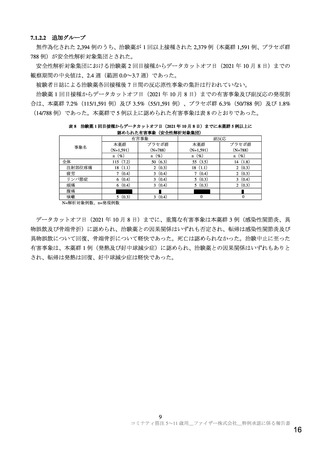
5~11 歳の年齢層における目標被験者数は、当初 2,250 例(本薬群とプラセボ群に 2:1 で無作為割付
(本薬群 1,500 例、プラセボ群 750 例、以下同順))と設定されたが、より多くの安全性データを収集
する旨、試験実施中に FDA から要請があり、2,250 例(1,500 例、750 例)が追加され、計 4,500 例(3,000
例、1,500 例)5)に変更された(治験実施計画書改訂第 2 版、20
7.1.2.1
年
月
日)。
先行グループ
無作為化された 2,285 例のうち、治験薬が 1 回以上接種された 2,268 例(本薬群 1,518 例、プラセボ群
750 例、以下同順)6)が安全性解析対象集団とされた。また、免疫原性評価例数として 450 例を収集す
るため、第Ⅱ/Ⅲ相パート開始前に無作為化された被験者のうち、すべての実施国の全治験実施施設での
最初の約 6 例を抽出することとされ、計 485 例(322 例、163 例)が免疫原性評価の対象とされた。この
うち、治験薬を 2 回接種され、治験薬 2 回接種後に 1 回以上の有効な免疫原性の結果が得られた 441 例
(294 例、147 例)が評価可能免疫原性集団とされ、そのうち治験薬 2 回目接種後 1 カ月までに SARSCoV-2 感染歴のない 394 例(264 例、130 例)が免疫原性の主要な解析対象集団とされた。
また、免疫ブリッジングの解析(免疫ブリッジングの計画については 7.R.1 参照)における比較対照
として C4591001 試験で治験薬 2 回接種を受けた 16~25 歳の年齢層の被験者から無作為に抽出された
350 例(300 例、50 例)のうち、治験薬 2 回接種後に 1 回以上の有効な免疫原性の結果が得られた 320
例(273 例、47 例)が評価可能免疫原性集団とされ、そのうち治験薬 2 回目接種後 1 カ月までに SARSCoV-2 感染歴のない 298 例(253 例、45 例)が免疫原性の主要な解析における比較対照とされた。
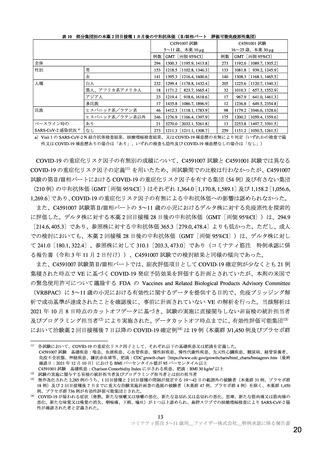
免疫原性について、主要評価項目は、過去に SARS-CoV-2 感染歴がない被験者における治験薬 2 回目
接種後 1 カ月時点の SARS-CoV-2 の中和抗体価(50%中和抗体価)とされ、C4591001 試験の第Ⅱ/Ⅲ相パ
ートの 16~25 歳の集団に対する GMT の比である GMR 及び当該年齢層との抗体応答率(抗体価がベー
スライン値(ベースライン値が LLOQ 未満の場合は LLOQ 値)から 4 倍以上に上昇した被験者の割合)
の差が算出された。なお、両主要評価項目を逐次的に検討することとされ、初めに GMR について評価
を行い、事前に設定された成功基準が達成された場合には抗体応答率について評価を行うこととされた。
5)
6)
計画当初、申請者は、米国における承認の要件として、小児の安全性データベースとして少なくとも 3,000 例必要とされていること
から、小児の他の年齢層で本薬の開発を進めていることも踏まえて、5~11 歳の小児の本薬群の例数として 1,500 例、プラセボ群 750
例(計 2,250 例)と設定した。その後、FDA から当該年齢層で本薬群の安全性データとして少なくとも 3,000 例を収集するよう要請
されたことから、計 4,500 例(本薬 3,000 例、プラセボ群 1,500 例)に変更された。免疫原性評価については、C4591007 試験(5~11
歳)の本薬群及び C4591001 試験(16~25 歳)本薬群の免疫原性サブセットにおける被験者数をそれぞれ 225 例とし、GMT の群間差
(対数変換値)を-0.2、標準偏差(対数変換値)を 0.65 と仮定し、免疫ブリッジングの評価の基準として GMR を 0.67 とした場合、
検出力は 90.4%となる。また、各群の抗体応答率を 90%と仮定し、免疫ブリッジングの評価の基準として抗体応答率の差を 10%とし
た場合、検出力は 92.6%となる。さらに、評価不能割合を 25%と仮定し、目標被験者数は各試験の本薬群でそれぞれ 300 例とされた。
なお、C4591007 試験(5~12 歳)のプラセボ群については、本薬群の目標被験者数の半数である 150 例とされた。
プラセボ群に割り付けられたが、誤って本薬が接種された 1 例については、本薬群として評価された。
6
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
13
第Ⅱ/Ⅲ相パート
5~11 歳の健康小児(状態が安定している基礎疾患を有する小児を含む)における本薬の免疫原性、
安全性及び忍容性を検討することを目的とした多施設共同無作為化観察者盲検プラセボ対照並行群間比
較試験が海外 4 カ国(米国、フィンランド、ポーランド及びスペイン)81 施設で実施された。被験者、
治験責任医師、治験実施施設のスタッフ(治験薬調製者及び接種者を除く)及び治験依頼者(事前規定
された本試験からは独立した一部のスタッフを除く)は盲検とされた。
用法・用量は、治験薬(本薬 10 µg 又はプラセボ)を 21 日間隔で 2 回(Day 1 及び Day 19~23)、筋
肉内接種することとされた。
5~11 歳の年齢層における目標被験者数は、当初 2,250 例(本薬群とプラセボ群に 2:1 で無作為割付
(本薬群 1,500 例、プラセボ群 750 例、以下同順))と設定されたが、より多くの安全性データを収集
する旨、試験実施中に FDA から要請があり、2,250 例(1,500 例、750 例)が追加され、計 4,500 例(3,000
例、1,500 例)5)に変更された(治験実施計画書改訂第 2 版、20
7.1.2.1
年
月
日)。
先行グループ
無作為化された 2,285 例のうち、治験薬が 1 回以上接種された 2,268 例(本薬群 1,518 例、プラセボ群
750 例、以下同順)6)が安全性解析対象集団とされた。また、免疫原性評価例数として 450 例を収集す
るため、第Ⅱ/Ⅲ相パート開始前に無作為化された被験者のうち、すべての実施国の全治験実施施設での
最初の約 6 例を抽出することとされ、計 485 例(322 例、163 例)が免疫原性評価の対象とされた。この
うち、治験薬を 2 回接種され、治験薬 2 回接種後に 1 回以上の有効な免疫原性の結果が得られた 441 例
(294 例、147 例)が評価可能免疫原性集団とされ、そのうち治験薬 2 回目接種後 1 カ月までに SARSCoV-2 感染歴のない 394 例(264 例、130 例)が免疫原性の主要な解析対象集団とされた。
また、免疫ブリッジングの解析(免疫ブリッジングの計画については 7.R.1 参照)における比較対照
として C4591001 試験で治験薬 2 回接種を受けた 16~25 歳の年齢層の被験者から無作為に抽出された
350 例(300 例、50 例)のうち、治験薬 2 回接種後に 1 回以上の有効な免疫原性の結果が得られた 320
例(273 例、47 例)が評価可能免疫原性集団とされ、そのうち治験薬 2 回目接種後 1 カ月までに SARSCoV-2 感染歴のない 298 例(253 例、45 例)が免疫原性の主要な解析における比較対照とされた。
免疫原性について、主要評価項目は、過去に SARS-CoV-2 感染歴がない被験者における治験薬 2 回目
接種後 1 カ月時点の SARS-CoV-2 の中和抗体価(50%中和抗体価)とされ、C4591001 試験の第Ⅱ/Ⅲ相パ
ートの 16~25 歳の集団に対する GMT の比である GMR 及び当該年齢層との抗体応答率(抗体価がベー
スライン値(ベースライン値が LLOQ 未満の場合は LLOQ 値)から 4 倍以上に上昇した被験者の割合)
の差が算出された。なお、両主要評価項目を逐次的に検討することとされ、初めに GMR について評価
を行い、事前に設定された成功基準が達成された場合には抗体応答率について評価を行うこととされた。
5)
6)
計画当初、申請者は、米国における承認の要件として、小児の安全性データベースとして少なくとも 3,000 例必要とされていること
から、小児の他の年齢層で本薬の開発を進めていることも踏まえて、5~11 歳の小児の本薬群の例数として 1,500 例、プラセボ群 750
例(計 2,250 例)と設定した。その後、FDA から当該年齢層で本薬群の安全性データとして少なくとも 3,000 例を収集するよう要請
されたことから、計 4,500 例(本薬 3,000 例、プラセボ群 1,500 例)に変更された。免疫原性評価については、C4591007 試験(5~11
歳)の本薬群及び C4591001 試験(16~25 歳)本薬群の免疫原性サブセットにおける被験者数をそれぞれ 225 例とし、GMT の群間差
(対数変換値)を-0.2、標準偏差(対数変換値)を 0.65 と仮定し、免疫ブリッジングの評価の基準として GMR を 0.67 とした場合、
検出力は 90.4%となる。また、各群の抗体応答率を 90%と仮定し、免疫ブリッジングの評価の基準として抗体応答率の差を 10%とし
た場合、検出力は 92.6%となる。さらに、評価不能割合を 25%と仮定し、目標被験者数は各試験の本薬群でそれぞれ 300 例とされた。
なお、C4591007 試験(5~12 歳)のプラセボ群については、本薬群の目標被験者数の半数である 150 例とされた。
プラセボ群に割り付けられたが、誤って本薬が接種された 1 例については、本薬群として評価された。
6
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
13