よむ、つかう、まなぶ。
【資料3-1】新型コロナワクチン(コミナティ筋注5~ 11 歳用)の承認について(医薬・生活衛生局の説明資料) (31 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
特例承認に係る報告(2)
令和 4 年 1 月 11 日
申請品目
[販
売
名]
コミナティ筋注 5~11 歳用
[一
般
名]
コロナウイルス修飾ウリジン RNA ワクチン(SARS-CoV-2)
(有効成分名:トジナメラン)
[申
請
者]
ファイザー株式会社
[申請年月日]
令和 3 年 11 月 10 日
[略語等一覧]
別記のとおり。
審査内容
1.
専門協議及びその後の機構における審査の概略は、以下のとおりである。なお、本専門協議の専門委
員は、本品目についての専門委員からの申し出等に基づき、「医薬品医療機器総合機構における専門協
議等の実施に関する達」(平成 20 年 12 月 25 日付け
1.1
20 達第 8 号)の規定により、指名した。
有効性について
専門協議では、報告(1)の「7.R.2 有効性について」の機構の判断は、専門委員から支持された。
なお、申請者は、オミクロン株に対する有効性について、現時点で 5~11 歳の小児の検討結果は得ら
れていないが、18~55 歳の者における予備的検討結果では、本薬 2 回接種後の重症化予防効果は期待で
き る 旨 説 明 し て い る ( https://www.businesswire.com/news/home/20211208005542/en/Pfizer-and-BioNTechProvide-Update-on-Omicron-Variant(最終確認日:2022 年 1 月 11 日))。
機構は、オミクロン株も含めた変異株の情報は引き続き収集し、得られた情報に基づき、適切な対応
を検討するよう申請者に伝達し、申請者は適切に対応する旨回答した。
1.2
安全性について
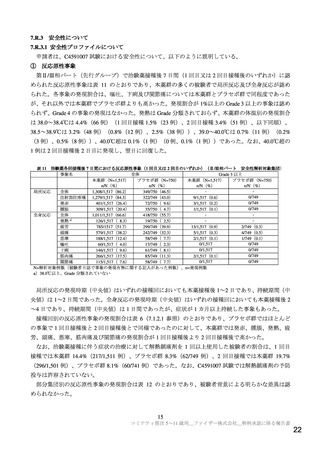
専門協議では、報告(1)の「7.R.3 安全性について」の機構の判断は、専門委員から支持された。
機構は、5~11 歳の小児における心筋炎・心膜炎の発現リスクについて、海外での製造販売後又は緊
急使用許可後の最新の情報を踏まえ、改めて説明するよう求め、申請者は以下のように回答した。
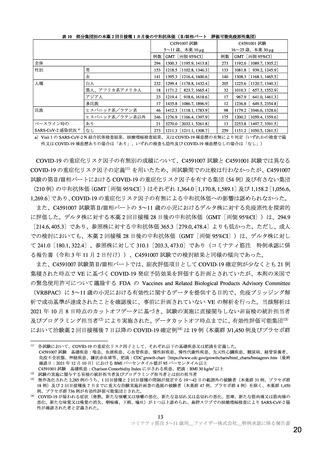
申請者の所有する安全性データベースにおける本薬の製造販売承認又は緊急使用許可から 2021 年 12
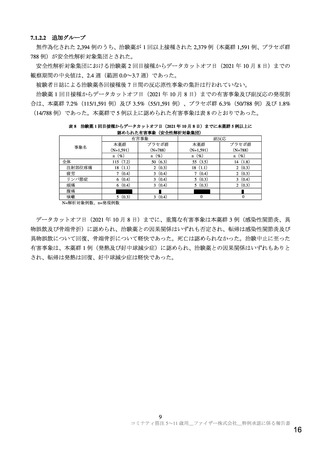
月 5 日までの報告のうち、5~11 歳の小児において心筋炎・心膜炎24)が疑われた症例は 12 例であった。
性別の内訳は男児 9 例、女児 3 例であり、7 例が本薬 2 回目接種後であった。いずれの症例も臨床検査
値、臨床経過等の情報が十分得られておらず、Brighton Collaboration の診断確実性基準を用いた分類では
24)
MedDRA 基本語:心筋炎、好酸球性心筋炎、巨細胞性心筋炎、過敏性心筋症、自己免疫性心筋炎、免疫性心筋炎、心膜炎、自己免疫
性心膜炎、癒着性心膜炎、収縮性心膜炎、胸膜心膜炎
24
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
31
令和 4 年 1 月 11 日
申請品目
[販
売
名]
コミナティ筋注 5~11 歳用
[一
般
名]
コロナウイルス修飾ウリジン RNA ワクチン(SARS-CoV-2)
(有効成分名:トジナメラン)
[申
請
者]
ファイザー株式会社
[申請年月日]
令和 3 年 11 月 10 日
[略語等一覧]
別記のとおり。
審査内容
1.
専門協議及びその後の機構における審査の概略は、以下のとおりである。なお、本専門協議の専門委
員は、本品目についての専門委員からの申し出等に基づき、「医薬品医療機器総合機構における専門協
議等の実施に関する達」(平成 20 年 12 月 25 日付け
1.1
20 達第 8 号)の規定により、指名した。
有効性について
専門協議では、報告(1)の「7.R.2 有効性について」の機構の判断は、専門委員から支持された。
なお、申請者は、オミクロン株に対する有効性について、現時点で 5~11 歳の小児の検討結果は得ら
れていないが、18~55 歳の者における予備的検討結果では、本薬 2 回接種後の重症化予防効果は期待で
き る 旨 説 明 し て い る ( https://www.businesswire.com/news/home/20211208005542/en/Pfizer-and-BioNTechProvide-Update-on-Omicron-Variant(最終確認日:2022 年 1 月 11 日))。
機構は、オミクロン株も含めた変異株の情報は引き続き収集し、得られた情報に基づき、適切な対応
を検討するよう申請者に伝達し、申請者は適切に対応する旨回答した。
1.2
安全性について
専門協議では、報告(1)の「7.R.3 安全性について」の機構の判断は、専門委員から支持された。
機構は、5~11 歳の小児における心筋炎・心膜炎の発現リスクについて、海外での製造販売後又は緊
急使用許可後の最新の情報を踏まえ、改めて説明するよう求め、申請者は以下のように回答した。
申請者の所有する安全性データベースにおける本薬の製造販売承認又は緊急使用許可から 2021 年 12
月 5 日までの報告のうち、5~11 歳の小児において心筋炎・心膜炎24)が疑われた症例は 12 例であった。
性別の内訳は男児 9 例、女児 3 例であり、7 例が本薬 2 回目接種後であった。いずれの症例も臨床検査
値、臨床経過等の情報が十分得られておらず、Brighton Collaboration の診断確実性基準を用いた分類では
24)
MedDRA 基本語:心筋炎、好酸球性心筋炎、巨細胞性心筋炎、過敏性心筋症、自己免疫性心筋炎、免疫性心筋炎、心膜炎、自己免疫
性心膜炎、癒着性心膜炎、収縮性心膜炎、胸膜心膜炎
24
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
31