よむ、つかう、まなぶ。
【資料3-1】新型コロナワクチン(コミナティ筋注5~ 11 歳用)の承認について(医薬・生活衛生局の説明資料) (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
機構は、以下のように考える。
FDA の「Licensure and Emergency Use Authorization of Vaccines to Prevent COVID-19 for Use in Pediatric
Populations」10)において、一般的に小児は COVID-19 発症や重症化の頻度が低く、小児集団で SARS-CoV2 ワクチンの有効性を検証するための検出力を確保した臨床試験の実施が困難な可能性があること、中
和抗体価が SARS-CoV-2 ワクチンの有効性を推測するバイオマーカーとなり得る知見が得られているこ
と(Nat Med 2021; 27: 1205-11)を踏まえて、成人等の別の集団でワクチンの有効性が検証されている場
合、中和抗体価の GMT 及び抗体応答率による免疫ブリッジングの手法を用いて小児の有効性を推測可
能であることが示されている。本邦においては、機構は「新型コロナウイルス(SARS-CoV-2)ワクチン
の評価に関する考え方(補遺 3) 免疫原性に基づく新型コロナウイルスワクチンの評価の考え方」(令
和 3 年 10 月 22 日
独立行政法人医薬品医療機器総合機構ワクチン等審査部)の中で、SARS-CoV-2 ワ
クチン接種後の中和抗体価が、COVID-19 発症予防効果と相関性を示すことが徐々に明らかになってき
ていること(Vaccine 2021; 39: 4423-8、Nat Med 2021; 27: 1205-11)を背景として、新規の SARS-CoV-2 ワ
クチンの開発において、既承認の SARS-CoV-2 ワクチンを比較対照として、免疫原性の指標に基づき有
効性を評価する免疫ブリッジングの手法を活用できることを示している。小児への適応拡大の評価にお
いても、同様の免疫ブリッジングの手法を用いて、16 歳以上の集団で既に有効性が確認されている本薬
の小児における有効性を評価することは可能と考える。
以上を踏まえ、申請者の説明のとおり、5~11 歳の小児に対する本剤の開発において、臨床試験で中
和抗体価を評価し、有効性が確認されている年齢集団との比較により 5~11 歳の小児における本剤の有
効性を評価する方針をとることは可能であり、また、上述のガイダンスの記載等を踏まえ、設定された
免疫ブリッジングに係る成功基準に基づき有効性を評価することは可能と判断した。
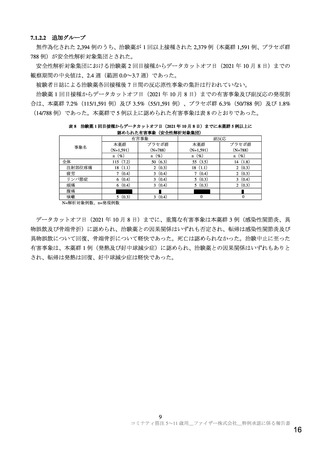
欧米をはじめとする海外において 2021 年 7~8 月にデルタ株の流行により増加した COVID-19 患者数
は、同年 9~10 月に一旦減少したが、その後再び増加傾向に転じている(https://covid19.who.int/(最終確
認日:2021 年 12 月 10 日))。本邦では、同年 12 月 10 日時点において SARS-CoV-2 新規陽性者数は低
値で推移しているが(https://www.mhlw.go.jp/stf/covid-19/kokunainohasseijoukyou.html(最終確認日:2021
年 12 月 10 日))、今後感染再拡大が起こる可能性はあり、小児に対しても可能な限り早期に SARSCoV-2 ワクチンを接種可能な状態とする必要がある。小児を対象とした国内臨床試験は実施されていな
いが、20 歳以上を対象とした国内臨床試験において、日本人での免疫原性及び安全性が確認されている
こと、本薬承認以降 12 歳以上の者に対する本薬の接種が進められ、国内での使用経験が多く集積されて
いることに加え、上述のとおり本剤開発に係る緊急性も考慮し、提出された海外 C4591007 試験の成績
に基づき本薬の免疫原性及び安全性を評価することとした。
7.R.2
有効性について
申請者は、5~11 歳の小児における本薬の有効性について、以下のように説明している。
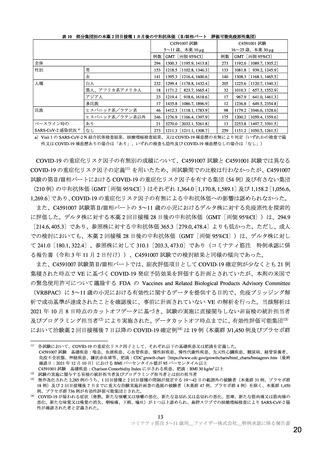
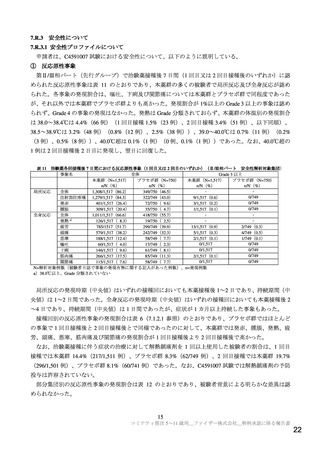
5~11 歳における本薬の有効性評価においては、C4591007 試験の第Ⅱ/Ⅲ相パートの主要評価項目と
して、本薬(10 µg)2 回目接種後 1 カ月時点の SARS-CoV-2(参照株)に対する中和抗体価(GMT 及び
抗体応答率)を評価し、本薬の COVID-19 発症予防効果を検証した C4591001 試験において本薬(30 µg)
2 回の接種を受けた 16~25 歳の被験者から無作為に抽出した集団と比較する計画とした。なお、免疫原
性データの比較対照については、免疫原性が年齢の影響を受けることを考慮し、より近い年齢の集団と
10)
https://www.fda.gov/media/149935/download(最終確認日:2021 年 12 月 10 日)
11
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
18
FDA の「Licensure and Emergency Use Authorization of Vaccines to Prevent COVID-19 for Use in Pediatric
Populations」10)において、一般的に小児は COVID-19 発症や重症化の頻度が低く、小児集団で SARS-CoV2 ワクチンの有効性を検証するための検出力を確保した臨床試験の実施が困難な可能性があること、中
和抗体価が SARS-CoV-2 ワクチンの有効性を推測するバイオマーカーとなり得る知見が得られているこ
と(Nat Med 2021; 27: 1205-11)を踏まえて、成人等の別の集団でワクチンの有効性が検証されている場
合、中和抗体価の GMT 及び抗体応答率による免疫ブリッジングの手法を用いて小児の有効性を推測可
能であることが示されている。本邦においては、機構は「新型コロナウイルス(SARS-CoV-2)ワクチン
の評価に関する考え方(補遺 3) 免疫原性に基づく新型コロナウイルスワクチンの評価の考え方」(令
和 3 年 10 月 22 日
独立行政法人医薬品医療機器総合機構ワクチン等審査部)の中で、SARS-CoV-2 ワ
クチン接種後の中和抗体価が、COVID-19 発症予防効果と相関性を示すことが徐々に明らかになってき
ていること(Vaccine 2021; 39: 4423-8、Nat Med 2021; 27: 1205-11)を背景として、新規の SARS-CoV-2 ワ
クチンの開発において、既承認の SARS-CoV-2 ワクチンを比較対照として、免疫原性の指標に基づき有
効性を評価する免疫ブリッジングの手法を活用できることを示している。小児への適応拡大の評価にお
いても、同様の免疫ブリッジングの手法を用いて、16 歳以上の集団で既に有効性が確認されている本薬
の小児における有効性を評価することは可能と考える。
以上を踏まえ、申請者の説明のとおり、5~11 歳の小児に対する本剤の開発において、臨床試験で中
和抗体価を評価し、有効性が確認されている年齢集団との比較により 5~11 歳の小児における本剤の有
効性を評価する方針をとることは可能であり、また、上述のガイダンスの記載等を踏まえ、設定された
免疫ブリッジングに係る成功基準に基づき有効性を評価することは可能と判断した。
欧米をはじめとする海外において 2021 年 7~8 月にデルタ株の流行により増加した COVID-19 患者数
は、同年 9~10 月に一旦減少したが、その後再び増加傾向に転じている(https://covid19.who.int/(最終確
認日:2021 年 12 月 10 日))。本邦では、同年 12 月 10 日時点において SARS-CoV-2 新規陽性者数は低
値で推移しているが(https://www.mhlw.go.jp/stf/covid-19/kokunainohasseijoukyou.html(最終確認日:2021
年 12 月 10 日))、今後感染再拡大が起こる可能性はあり、小児に対しても可能な限り早期に SARSCoV-2 ワクチンを接種可能な状態とする必要がある。小児を対象とした国内臨床試験は実施されていな
いが、20 歳以上を対象とした国内臨床試験において、日本人での免疫原性及び安全性が確認されている
こと、本薬承認以降 12 歳以上の者に対する本薬の接種が進められ、国内での使用経験が多く集積されて
いることに加え、上述のとおり本剤開発に係る緊急性も考慮し、提出された海外 C4591007 試験の成績
に基づき本薬の免疫原性及び安全性を評価することとした。
7.R.2
有効性について
申請者は、5~11 歳の小児における本薬の有効性について、以下のように説明している。
5~11 歳における本薬の有効性評価においては、C4591007 試験の第Ⅱ/Ⅲ相パートの主要評価項目と
して、本薬(10 µg)2 回目接種後 1 カ月時点の SARS-CoV-2(参照株)に対する中和抗体価(GMT 及び
抗体応答率)を評価し、本薬の COVID-19 発症予防効果を検証した C4591001 試験において本薬(30 µg)
2 回の接種を受けた 16~25 歳の被験者から無作為に抽出した集団と比較する計画とした。なお、免疫原
性データの比較対照については、免疫原性が年齢の影響を受けることを考慮し、より近い年齢の集団と
10)
https://www.fda.gov/media/149935/download(最終確認日:2021 年 12 月 10 日)
11
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
18