よむ、つかう、まなぶ。
【資料3-1】新型コロナワクチン(コミナティ筋注5~ 11 歳用)の承認について(医薬・生活衛生局の説明資料) (47 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
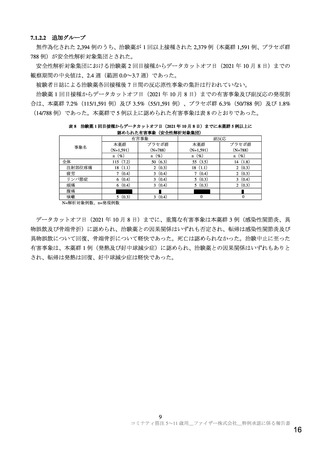
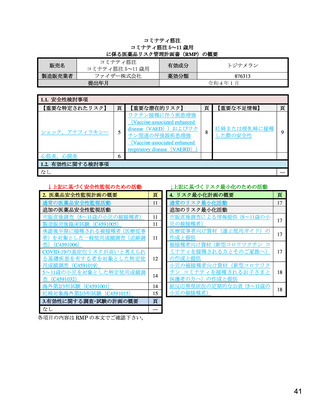
剤接種時におけるショック,アナフィラキシーについて注意喚起を行い,被接種者の安全性
確保を図るため。
心筋炎,心膜炎
重要な特定されたリスクとした理由:
コロナウイルス修飾ウリジン RNA ワクチン(SARS-CoV-2)が心筋炎,心膜炎を引き起こす作用
機序は明らかではない。しかしながら,以下の理由から重要な特定されたリスクとした。
海外において,コロナウイルス修飾ウリジン RNA ワクチン(SARS-CoV-2)接種後に心筋炎,心
膜炎が報告されている。初回免疫において報告された症例の多くは若年男性であり,特に 2 回目
接種後数日以内に発現している。大多数の症例で,入院による安静臥床により症状が改善してい
る a)。
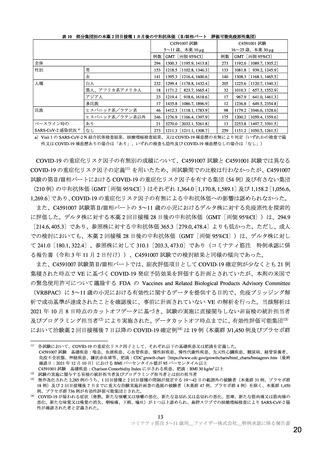
国内においては,接種開始後の国内副反応疑い報告における心筋炎,心膜炎の報告率と,国内の
医療情報データベースを用いて算出した一般集団から推測される心筋炎,心膜炎の発現率とを比
較したところ,初回免疫として本剤 2 回接種後の若年男性で頻度が高いことが示唆された b)。
また,接種開始から 2021 年 11 月 14 日までに報告された心筋炎,心膜炎に関する国内副反応疑
い報告*において,重篤な心筋炎,心膜炎の副反応疑いが 281 件報告されており**,専門家の因果
関係評価において本剤と事象との因果関係が否定できないと評価された報告はないものの,その
中には致命的な転帰に至った症例が報告されている b)。
a) Clinical Considerations: Myocarditis and Pericarditis after Receipt of mRNA COVID-19 Vaccines Among Adolescents and
Young Adults.
b) 第 73 回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和 3 年度第 23 回薬事・食品衛生審議会薬事分
科会医薬品等安全対策部会安全対策調査会(合同開催)資料
*医薬品,医療機器等の品質,有効性及び安全性の確保等に関する法律第 68 条の 10 第 1 項に基
づき,「重篤」と判断された症例について報告されたもの
**国内における推定接種回数(2021 年 2 月 17 日~2021 年 11 月 14 日):163,059,502 回接種(1
回目・2 回目接種合計)
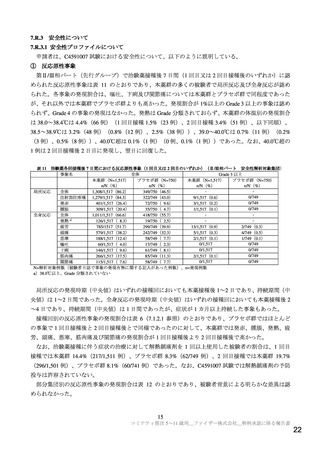
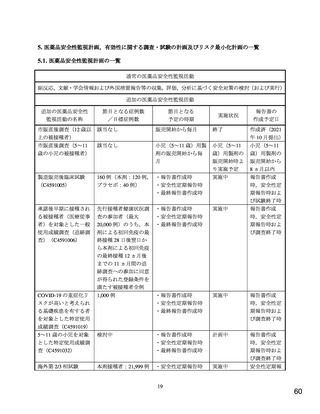
医薬品安全性監視活動の内容及びその選択理由:
【内容】
通常の医薬品安全性監視活動
追加の医薬品安全性監視活動として,以下を実施する。
1. 使用成績調査(特定使用成績調査)(C4591032)
2. 海外第 2/3 相試験(C4591001)
3. 妊婦対象海外第 2/3 相試験(C4591015)
【選択理由】
通常の医薬品安全性監視活動により,心筋炎,心膜炎の発現状況に関する情報を幅広く収集
するため。
使用成績調査および海外臨床試験において,心筋炎,心膜炎に関する情報を収集するため。
6
47
確保を図るため。
心筋炎,心膜炎
重要な特定されたリスクとした理由:
コロナウイルス修飾ウリジン RNA ワクチン(SARS-CoV-2)が心筋炎,心膜炎を引き起こす作用
機序は明らかではない。しかしながら,以下の理由から重要な特定されたリスクとした。
海外において,コロナウイルス修飾ウリジン RNA ワクチン(SARS-CoV-2)接種後に心筋炎,心
膜炎が報告されている。初回免疫において報告された症例の多くは若年男性であり,特に 2 回目
接種後数日以内に発現している。大多数の症例で,入院による安静臥床により症状が改善してい
る a)。
国内においては,接種開始後の国内副反応疑い報告における心筋炎,心膜炎の報告率と,国内の
医療情報データベースを用いて算出した一般集団から推測される心筋炎,心膜炎の発現率とを比
較したところ,初回免疫として本剤 2 回接種後の若年男性で頻度が高いことが示唆された b)。
また,接種開始から 2021 年 11 月 14 日までに報告された心筋炎,心膜炎に関する国内副反応疑
い報告*において,重篤な心筋炎,心膜炎の副反応疑いが 281 件報告されており**,専門家の因果
関係評価において本剤と事象との因果関係が否定できないと評価された報告はないものの,その
中には致命的な転帰に至った症例が報告されている b)。
a) Clinical Considerations: Myocarditis and Pericarditis after Receipt of mRNA COVID-19 Vaccines Among Adolescents and
Young Adults.
b) 第 73 回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和 3 年度第 23 回薬事・食品衛生審議会薬事分
科会医薬品等安全対策部会安全対策調査会(合同開催)資料
*医薬品,医療機器等の品質,有効性及び安全性の確保等に関する法律第 68 条の 10 第 1 項に基
づき,「重篤」と判断された症例について報告されたもの
**国内における推定接種回数(2021 年 2 月 17 日~2021 年 11 月 14 日):163,059,502 回接種(1
回目・2 回目接種合計)
医薬品安全性監視活動の内容及びその選択理由:
【内容】
通常の医薬品安全性監視活動
追加の医薬品安全性監視活動として,以下を実施する。
1. 使用成績調査(特定使用成績調査)(C4591032)
2. 海外第 2/3 相試験(C4591001)
3. 妊婦対象海外第 2/3 相試験(C4591015)
【選択理由】
通常の医薬品安全性監視活動により,心筋炎,心膜炎の発現状況に関する情報を幅広く収集
するため。
使用成績調査および海外臨床試験において,心筋炎,心膜炎に関する情報を収集するため。
6
47