よむ、つかう、まなぶ。
資料2-1:前回部会における主な指摘事項への対応(臨床研究中核病院の承認要件見直しについて) (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第38回 11/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
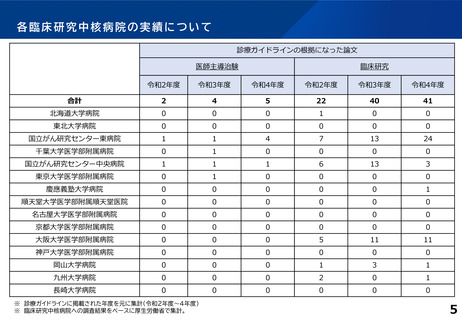
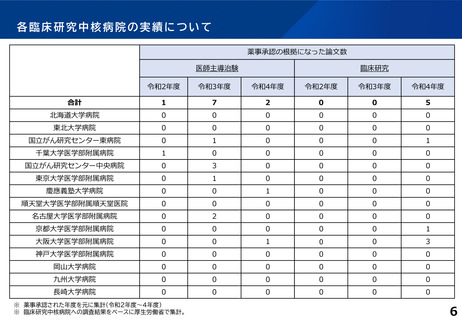
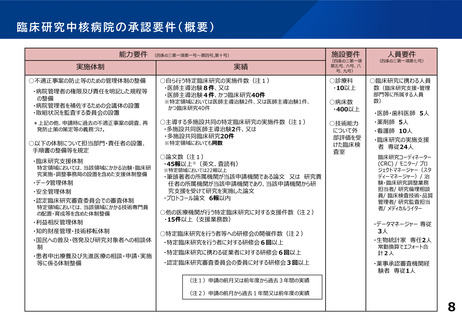
臨床研究中核病院の承認要件に関する背景と課題
前回見直し時(2019年)の背景
○ 革新的な医薬品・医療機器の研究開発を目的として設置された臨床研究中核病院に対して
は、質の高い臨床試験の実施、人材育成、他施設支援等の役割が求められ、それに対応した
要件を設定していたが、
•
•
•
•
臨床研究法(平成 29 年法律第 16 号)の制定及び施行といった制度基盤・背景の変化
「診療の最適化のための研究」への要求
研究開発の高度化に伴う人材育成の強化と財政的リソースの効率化への要求
リアルワールドデータの活用と言った新たな開発手法の登場
などの臨床研究・治験を取り巻く環境の変化を踏まえ、臨床研究中核病院の在り方を検討。
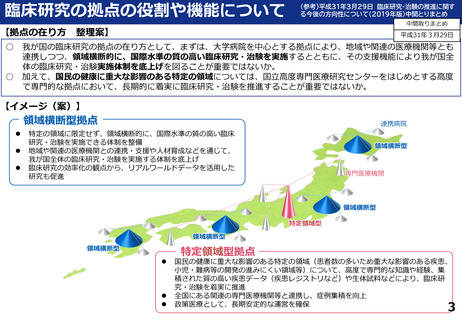
○ 特に、既存の臨床研究中核病院や製薬企業による取組の下では、必要とされる研究開発が
なかなか進まない疾病領域、すなわち小児疾病や難病等の重要な疾病領域の臨床研究・治験
に関しては、国として、国立高度専門医療研究センターを整備を行っており、疾病領域を特定
した取組を行っており、それらの領域に特化した拠点の在り方について検討を行った。
2
前回見直し時(2019年)の背景
○ 革新的な医薬品・医療機器の研究開発を目的として設置された臨床研究中核病院に対して
は、質の高い臨床試験の実施、人材育成、他施設支援等の役割が求められ、それに対応した
要件を設定していたが、
•
•
•
•
臨床研究法(平成 29 年法律第 16 号)の制定及び施行といった制度基盤・背景の変化
「診療の最適化のための研究」への要求
研究開発の高度化に伴う人材育成の強化と財政的リソースの効率化への要求
リアルワールドデータの活用と言った新たな開発手法の登場
などの臨床研究・治験を取り巻く環境の変化を踏まえ、臨床研究中核病院の在り方を検討。
○ 特に、既存の臨床研究中核病院や製薬企業による取組の下では、必要とされる研究開発が
なかなか進まない疾病領域、すなわち小児疾病や難病等の重要な疾病領域の臨床研究・治験
に関しては、国として、国立高度専門医療研究センターを整備を行っており、疾病領域を特定
した取組を行っており、それらの領域に特化した拠点の在り方について検討を行った。
2