よむ、つかう、まなぶ。
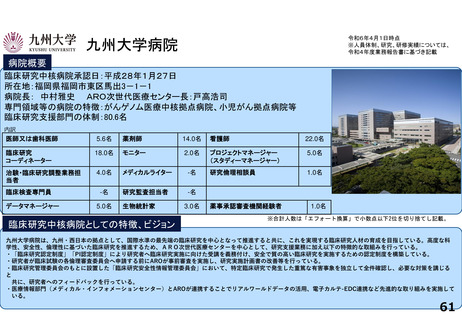
資料2-1:前回部会における主な指摘事項への対応(臨床研究中核病院の承認要件見直しについて) (54 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第38回 11/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
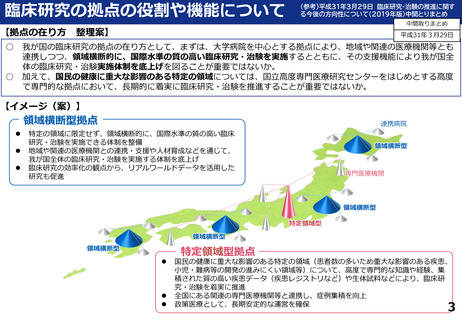
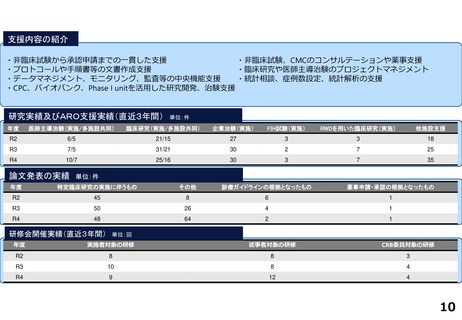
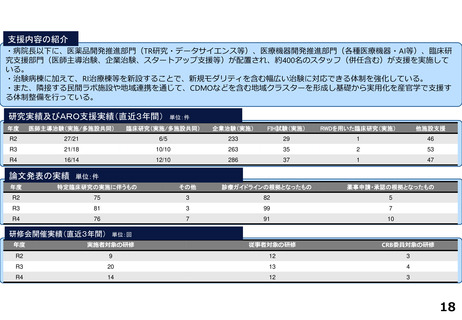
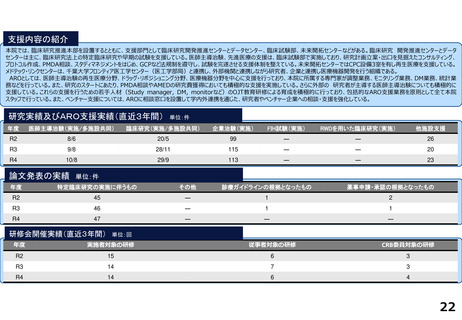
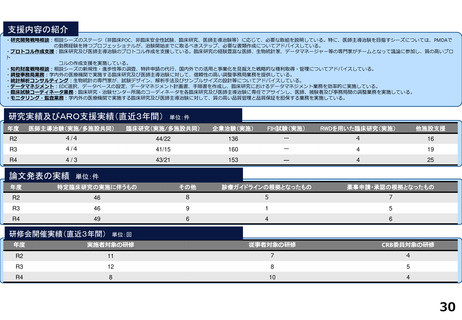
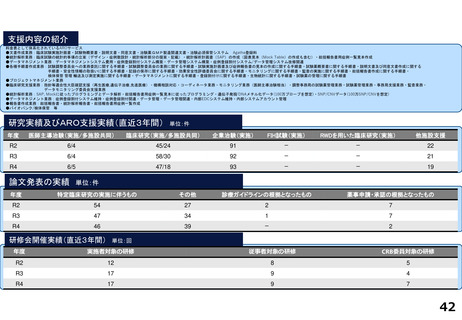
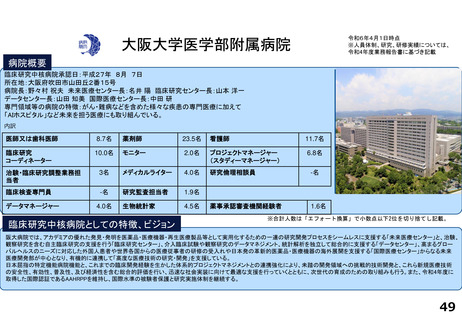
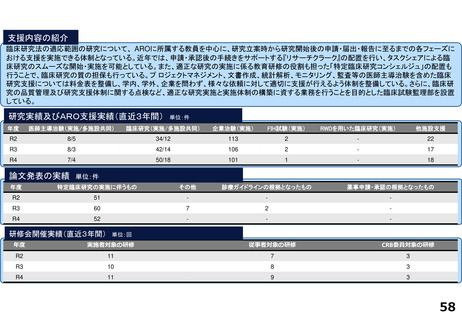
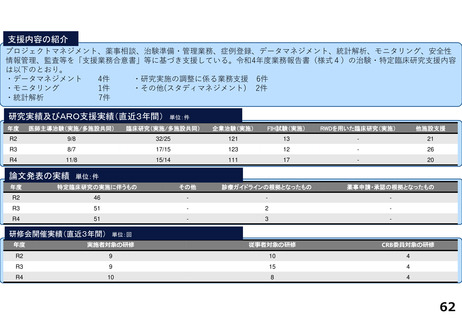
支援内容の紹介
・学内研究者や学外アカデミア、企業に対して、研究開発戦略、臨床研究準備、プロジェクトマネジメント、研究事務局支援、倫
理委員会審査、臨床研究コーディネータ(CRC)、試験物管理、症例登録、データマネジメント、EDC利用料、モニタリング、統
計解析、監査、総括報告書作成、見学受入業務に関する支援を実施している。
研究実績及びARO支援実績(直近3年間) 単位:件
年度
医師主導治験(実施/多施設共同)
臨床研究(実施/多施設共同)
企業治験(実施)
FIH試験(実施)
RWDを用いた臨床研究(実施)
他施設支援
R2
9/9
16/8
142
-
-
16
R3
9/9
22/8
175
-
-
16
R4
4/4
40/16
179
3
-
17
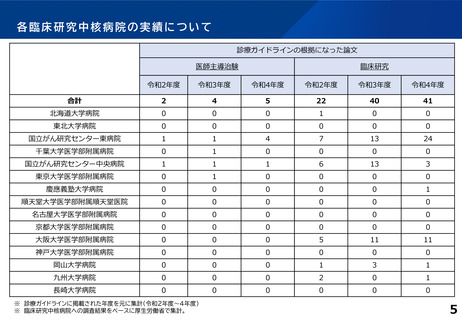
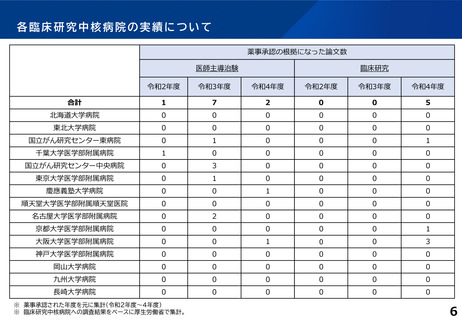
論文発表の実績 単位:件
年度
特定臨床研究の実施に伴うもの
その他
診療ガイドラインの根拠となったもの
薬事申請・承認の根拠となったもの
R2
49
-
-
-
R3
45
-
-
-
R4
45
-
-
-
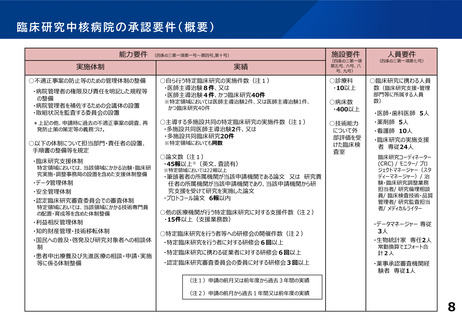
研修会開催実績(直近3年間)
単位:回
年度
実施者対象の研修
従事者対象の研修
CRB委員対象の研修
R2
8
15
4
R3
9
20
5
R4
13
14
4
54
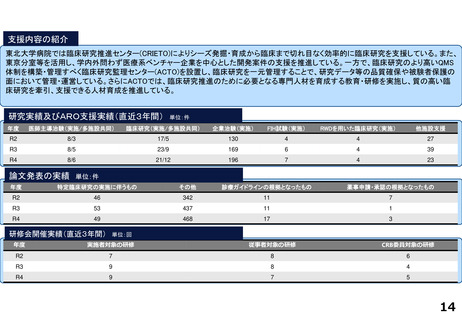
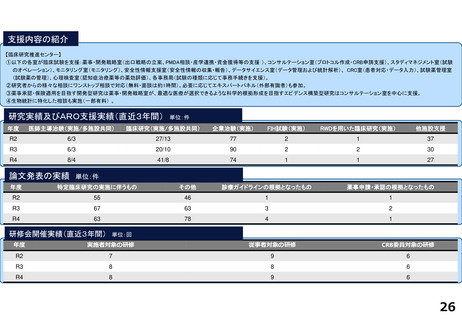
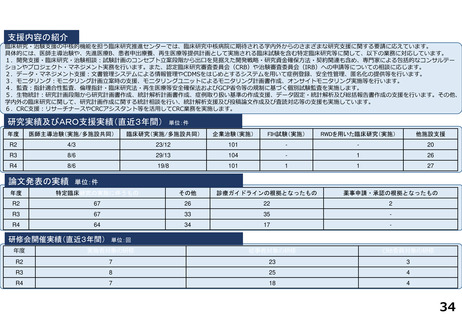
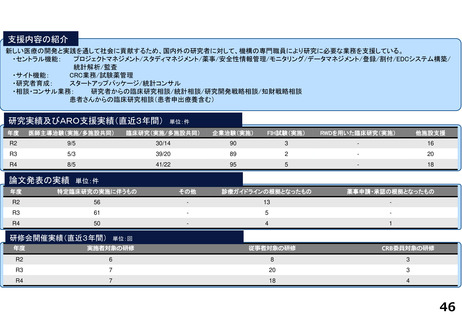
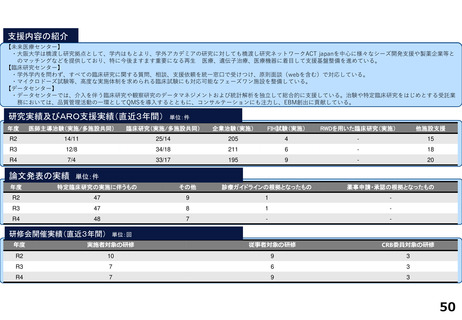
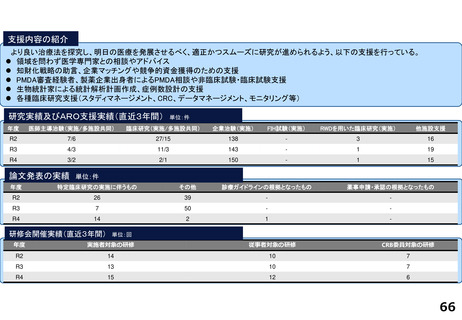
・学内研究者や学外アカデミア、企業に対して、研究開発戦略、臨床研究準備、プロジェクトマネジメント、研究事務局支援、倫
理委員会審査、臨床研究コーディネータ(CRC)、試験物管理、症例登録、データマネジメント、EDC利用料、モニタリング、統
計解析、監査、総括報告書作成、見学受入業務に関する支援を実施している。
研究実績及びARO支援実績(直近3年間) 単位:件
年度
医師主導治験(実施/多施設共同)
臨床研究(実施/多施設共同)
企業治験(実施)
FIH試験(実施)
RWDを用いた臨床研究(実施)
他施設支援
R2
9/9
16/8
142
-
-
16
R3
9/9
22/8
175
-
-
16
R4
4/4
40/16
179
3
-
17
論文発表の実績 単位:件
年度
特定臨床研究の実施に伴うもの
その他
診療ガイドラインの根拠となったもの
薬事申請・承認の根拠となったもの
R2
49
-
-
-
R3
45
-
-
-
R4
45
-
-
-
研修会開催実績(直近3年間)
単位:回
年度
実施者対象の研修
従事者対象の研修
CRB委員対象の研修
R2
8
15
4
R3
9
20
5
R4
13
14
4
54