よむ、つかう、まなぶ。
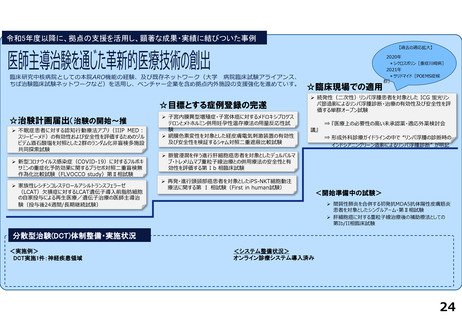
資料2-1:前回部会における主な指摘事項への対応(臨床研究中核病院の承認要件見直しについて) (34 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第38回 11/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
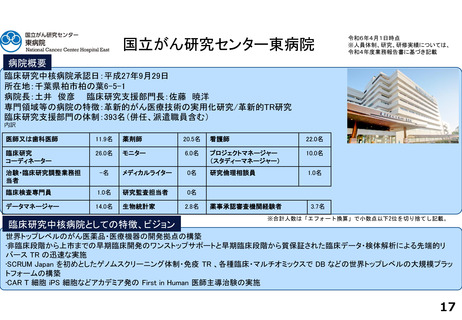
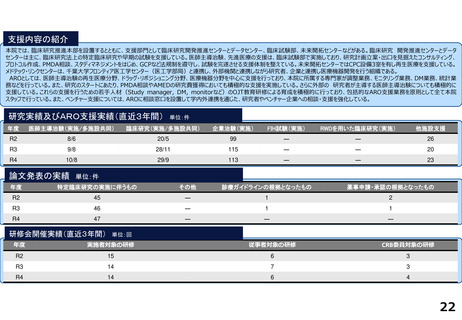
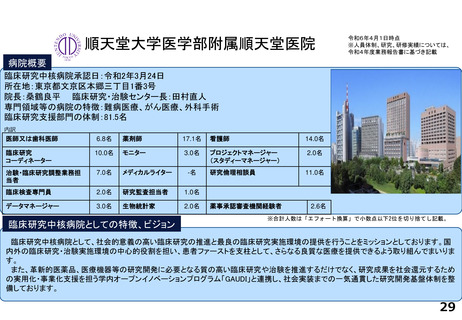
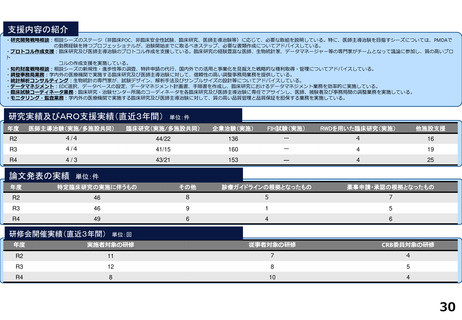
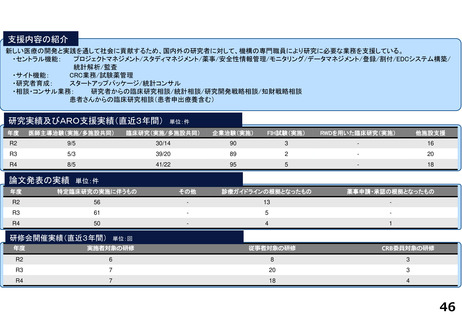
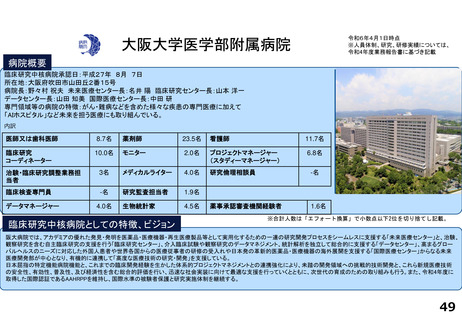
支援内容の紹介
臨床研究・治験支援の中核的機能を担う臨床研究推進センターでは、臨床研究中核病院に期待される学内外からのさまざまな研究支援に関する要請に応えています。
具体的には、医師主導治験や、先進医療B、患者申出療養、再生医療等提供計画として実施される臨床試験を含む特定臨床研究等に関して、以下の業務に対応しています。
1.開発支援・臨床研究・治験相談:試験計画のコンセプト立案段階から出口を見据えた開発戦略・研究資金確保方法・契約関連も含め、専門家による包括的なコンサルテー
ションやプロジェクト・マネジメント実務を行います。また、認定臨床研究審査委員会(CRB)や治験審査委員会(IRB)への申請等についての相談に応じます。
2.データ・マネジメント支援:文書管理システムによる情報管理やCDMSをはじめとするシステムを用いて症例登録、安全性管理、匿名化の提供等を行います。
3.モニタリング:モニタリング計画立案時の支援、モニタリングユニットによるモニタリング計画書作成、オンサイトモニタリング実施等を行います。
4.監査:指針適合性監査、倫理指針・臨床研究法・再生医療等安全確保法およびGCP省令等の規制に基づく個別試験監査を実施します。
5.生物統計:研究計画段階から研究計画書作成、統計解析計画書作成、症例取り扱い基準の作成支援、データ固定・統計解析及び総括報告書作成の支援を行います。その他、
学内外の臨床研究に関して、研究計画作成に関する統計相談を行い、統計解析支援及び投稿論文作成及び査読対応等の支援も実施しています。
6.CRC支援:リサーチナースやCRCアシスタント等を活用してCRC業務を実施します。
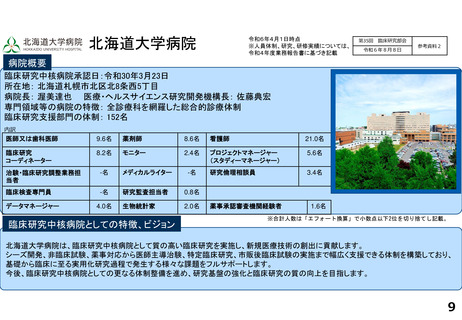
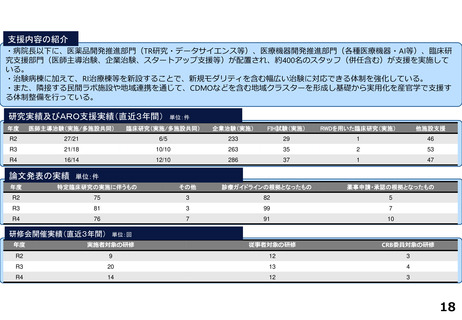
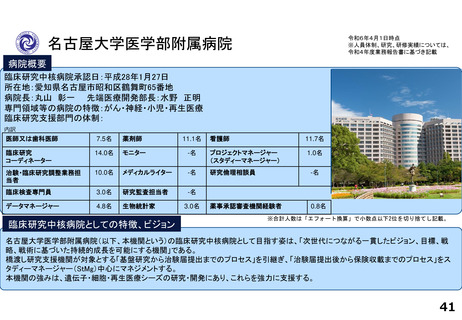
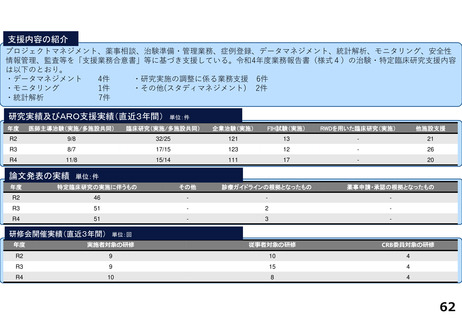
研究実績及びARO支援実績(直近3年間) 単位:件
年度
医師主導治験(実施/多施設共同)
臨床研究(実施/多施設共同)
企業治験(実施)
FIH試験(実施)
RWDを用いた臨床研究(実施)
他施設支援
R2
4/3
23/12
101
-
-
20
R3
8/6
29/13
104
-
1
26
R4
8/6
19/8
101
1
1
27
論文発表の実績 単位:件
年度
特定臨床研究の実施に伴うもの
その他
診療ガイドラインの根拠となったもの
薬事申請・承認の根拠となったもの
R2
67
26
22
2
R3
67
33
35
-
R4
64
34
17
-
研修会開催実績(直近3年間)
単位:回
年度
実施者対象の研修
従事者対象の研修
CRB委員対象の研修
R2
7
23
3
R3
8
25
4
R4
7
18
4
34
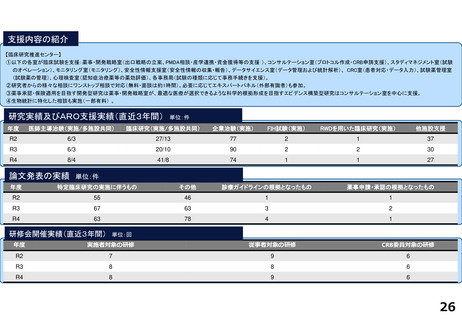
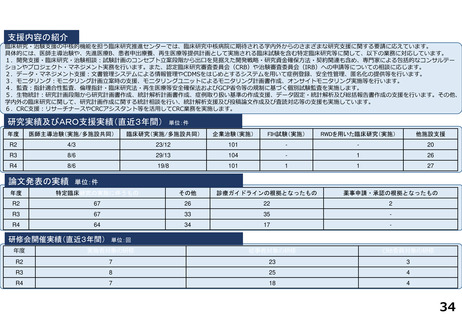
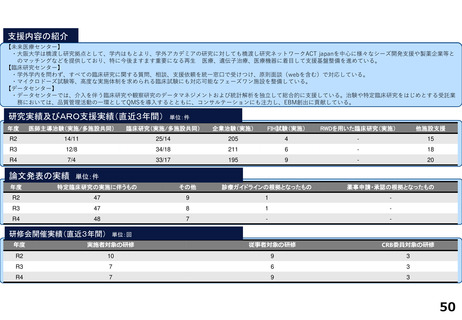
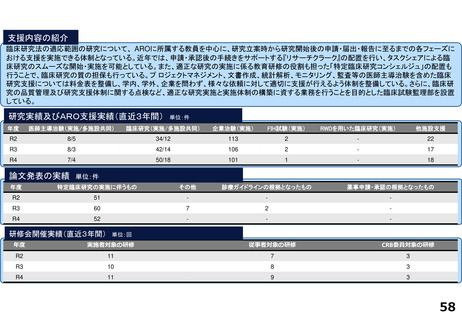
臨床研究・治験支援の中核的機能を担う臨床研究推進センターでは、臨床研究中核病院に期待される学内外からのさまざまな研究支援に関する要請に応えています。
具体的には、医師主導治験や、先進医療B、患者申出療養、再生医療等提供計画として実施される臨床試験を含む特定臨床研究等に関して、以下の業務に対応しています。
1.開発支援・臨床研究・治験相談:試験計画のコンセプト立案段階から出口を見据えた開発戦略・研究資金確保方法・契約関連も含め、専門家による包括的なコンサルテー
ションやプロジェクト・マネジメント実務を行います。また、認定臨床研究審査委員会(CRB)や治験審査委員会(IRB)への申請等についての相談に応じます。
2.データ・マネジメント支援:文書管理システムによる情報管理やCDMSをはじめとするシステムを用いて症例登録、安全性管理、匿名化の提供等を行います。
3.モニタリング:モニタリング計画立案時の支援、モニタリングユニットによるモニタリング計画書作成、オンサイトモニタリング実施等を行います。
4.監査:指針適合性監査、倫理指針・臨床研究法・再生医療等安全確保法およびGCP省令等の規制に基づく個別試験監査を実施します。
5.生物統計:研究計画段階から研究計画書作成、統計解析計画書作成、症例取り扱い基準の作成支援、データ固定・統計解析及び総括報告書作成の支援を行います。その他、
学内外の臨床研究に関して、研究計画作成に関する統計相談を行い、統計解析支援及び投稿論文作成及び査読対応等の支援も実施しています。
6.CRC支援:リサーチナースやCRCアシスタント等を活用してCRC業務を実施します。
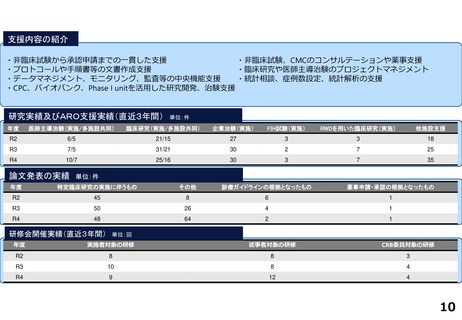
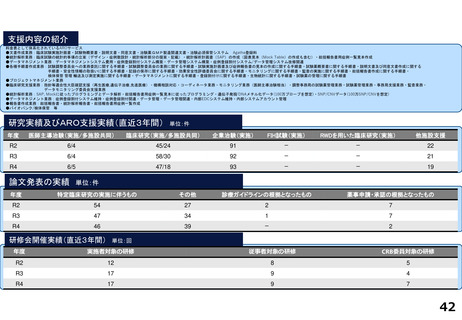
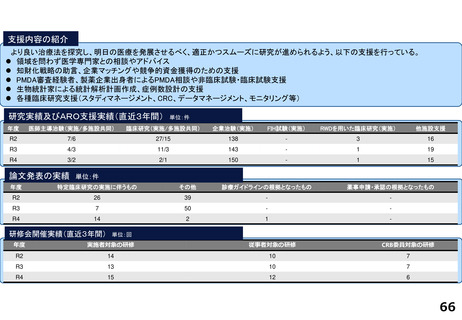
研究実績及びARO支援実績(直近3年間) 単位:件
年度
医師主導治験(実施/多施設共同)
臨床研究(実施/多施設共同)
企業治験(実施)
FIH試験(実施)
RWDを用いた臨床研究(実施)
他施設支援
R2
4/3
23/12
101
-
-
20
R3
8/6
29/13
104
-
1
26
R4
8/6
19/8
101
1
1
27
論文発表の実績 単位:件
年度
特定臨床研究の実施に伴うもの
その他
診療ガイドラインの根拠となったもの
薬事申請・承認の根拠となったもの
R2
67
26
22
2
R3
67
33
35
-
R4
64
34
17
-
研修会開催実績(直近3年間)
単位:回
年度
実施者対象の研修
従事者対象の研修
CRB委員対象の研修
R2
7
23
3
R3
8
25
4
R4
7
18
4
34