よむ、つかう、まなぶ。
資料2-1:前回部会における主な指摘事項への対応(臨床研究中核病院の承認要件見直しについて) (40 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第38回 11/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
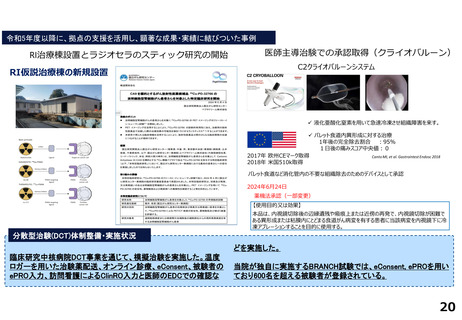
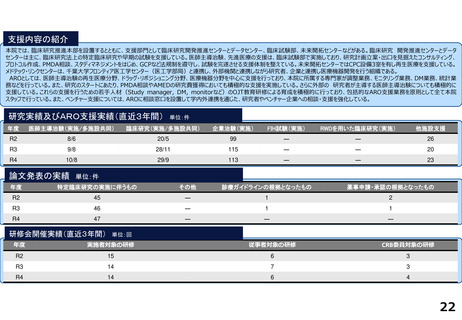
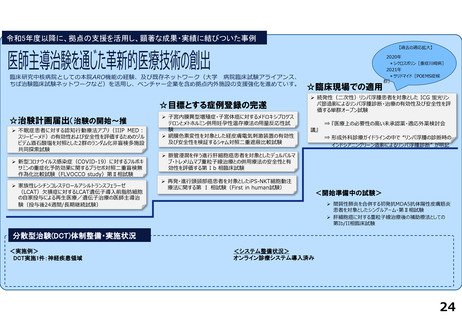
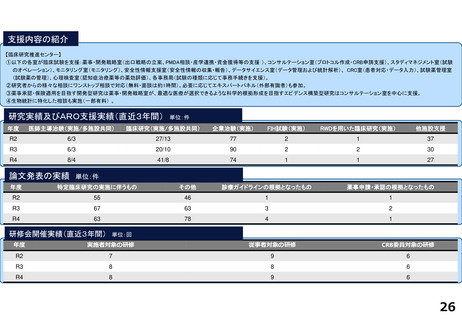
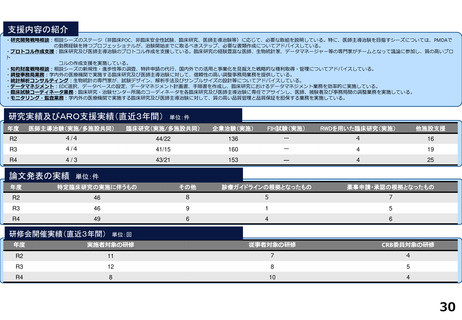
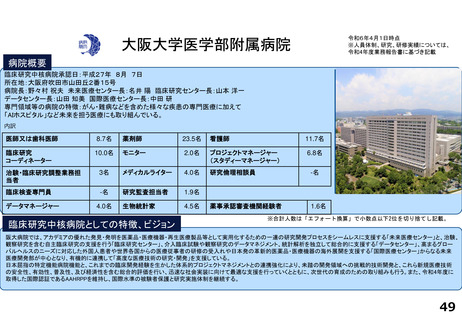
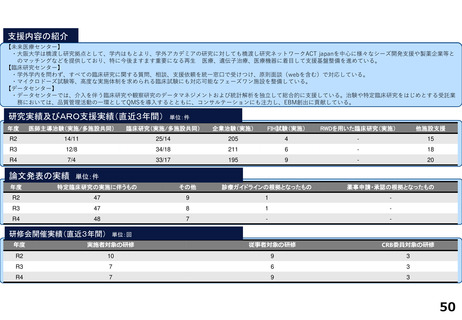
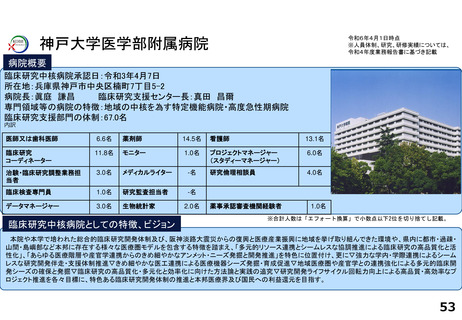
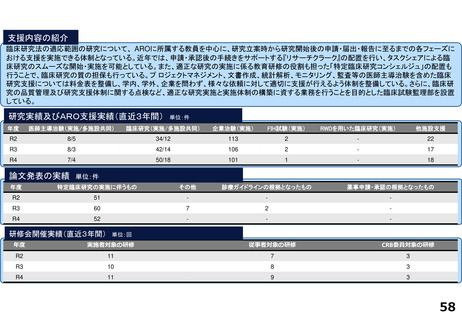
令和5年度以降に、拠点の支援を活用し、顕著な成果・実績に結びついた事例
◼ 日本主導の第III相国際共同医師主導治験
◼ PATHWAY試験において、無増悪生存期間(PFS)が
有意に延長したことをASCO2023で発表
◼ 2024年1月15日付で添付文書が改訂。Palbociclibの
Tamoxifenとの併用が可能に。台湾でも申請中
◼ 日本初の先進医療による医療機器の薬事承認取得
◼ 先進医療下の特定臨床研究「早期乳癌へのラジオ波熱
焼灼療法の有効性の検証と標準化に向けた多施設共同
研究(RAFAELO試験/NCCH1409)」の結果に基づき、早
期乳がんに対するラジオ波焼灼療法が薬事承認・保険
適用を取得
◼ 主要評価項目を達成したことをASCO2024で発表した。
分散型治験(DCT)体制整備・実施状況
医師主導治験2件、企業治験1件でDCTを導入済み
<実施例>
①希少がんを対象とした医師主導治験 2件
②企業治験 1件
• 医師主導治験ではフルリモートで実施可能なDCTプラット
フォーム(オンライン診療、データ共有、eConsent等)を構
築
• 全国に先駆けてセキュアなクラウド型データ共有システム
を構築
<システム整備状況>
40
◼ 日本主導の第III相国際共同医師主導治験
◼ PATHWAY試験において、無増悪生存期間(PFS)が
有意に延長したことをASCO2023で発表
◼ 2024年1月15日付で添付文書が改訂。Palbociclibの
Tamoxifenとの併用が可能に。台湾でも申請中
◼ 日本初の先進医療による医療機器の薬事承認取得
◼ 先進医療下の特定臨床研究「早期乳癌へのラジオ波熱
焼灼療法の有効性の検証と標準化に向けた多施設共同
研究(RAFAELO試験/NCCH1409)」の結果に基づき、早
期乳がんに対するラジオ波焼灼療法が薬事承認・保険
適用を取得
◼ 主要評価項目を達成したことをASCO2024で発表した。
分散型治験(DCT)体制整備・実施状況
医師主導治験2件、企業治験1件でDCTを導入済み
<実施例>
①希少がんを対象とした医師主導治験 2件
②企業治験 1件
• 医師主導治験ではフルリモートで実施可能なDCTプラット
フォーム(オンライン診療、データ共有、eConsent等)を構
築
• 全国に先駆けてセキュアなクラウド型データ共有システム
を構築
<システム整備状況>
40