よむ、つかう、まなぶ。
資料2-1:前回部会における主な指摘事項への対応(臨床研究中核病院の承認要件見直しについて) (56 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第38回 11/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
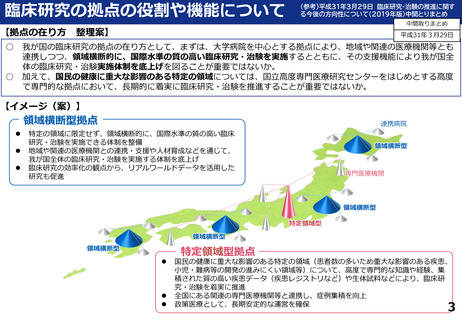
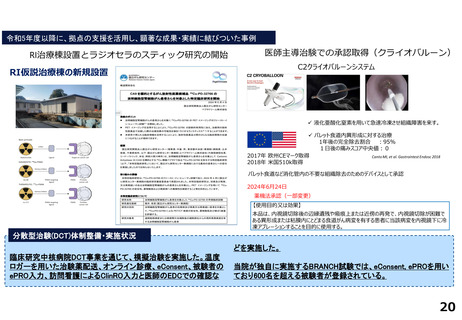
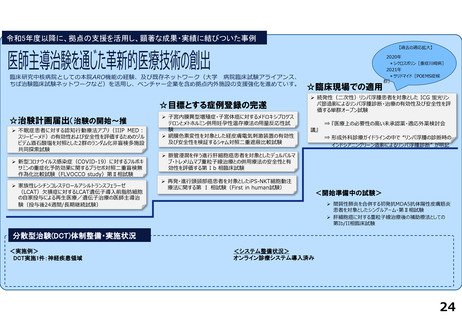
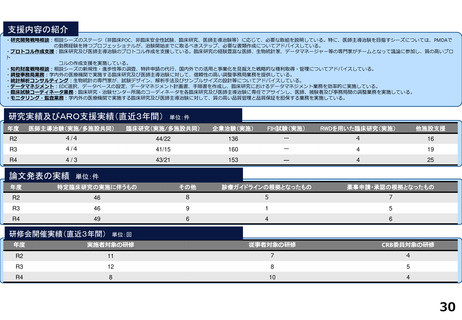
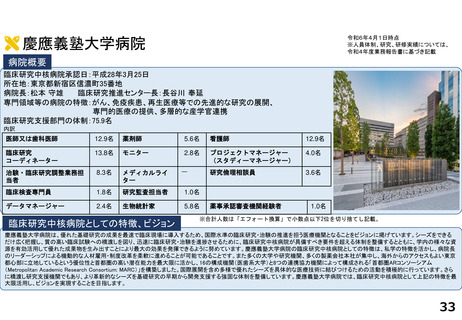
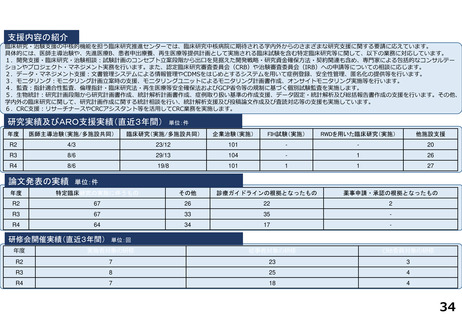
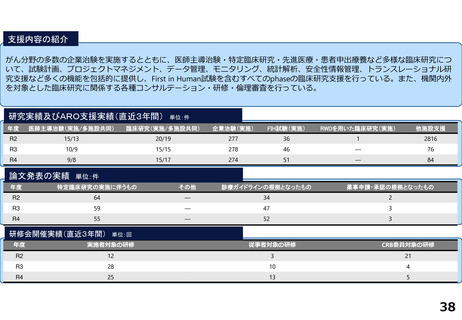
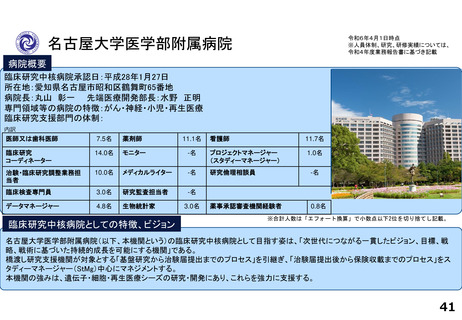
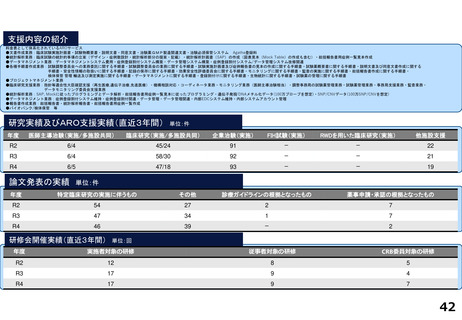
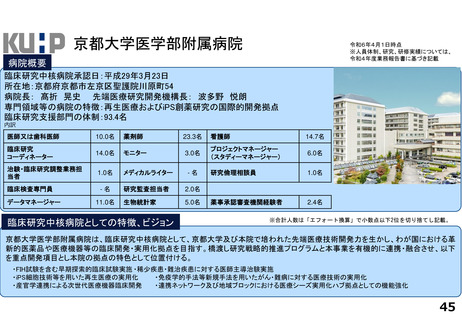
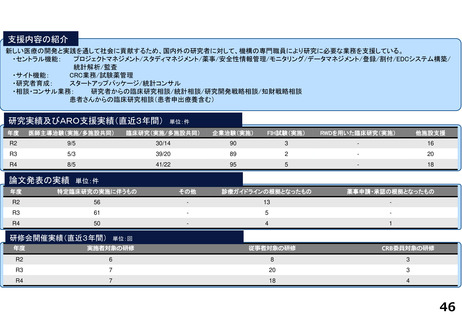
令和5年度以降に、拠点の支援を活用し、顕著な成果・実績に結びついた事例
近接する消化管等のため粒子線治療が困難な患者を対象に悪性腫瘍
と消化管等との間隙確保を目的とした、放射線治療用吸収性組織ス
ペーサを当院が発案し、企業と協力しつつ主体的に開発を進めた。臨
床研究推進センターは、企業交渉、臨床試験結果の検討や保険適用に
関する支援を実施し、2018年12月に製造販売承認を取得、 2019年に
は保険収載され、粒子線治療前のスペーサ留置術が保険適用となり、
2023年9月からは、X線治療前のスペーサ留置術が保険適用となった。
クラス分類Ⅳ(高度管理医療機器)承認番号:23000BZX00381000)
鼻腔内の観察部位を変更する際の抜き差しの煩雑さを解消し、患部への挿入が容易となるよ
う、軟性鏡・硬性鏡両方の特長を備えもつことで医師の手技効率向上に寄与する耳鼻咽喉ビデ
オスコープを当院と企業とで共同開発し、2023年5月に医療機器認証を受けた。
クラス分類
クラスⅡ (特定保守管理医療機器)
医療機器認証番号
305AFBZX00046000」
分散型治験(DCT)体制整備・実施状況
・整形外科領域の医師主導治験:被験者2名に対してDCT(配送業者による患者宅への治験薬配送)を実施済み、予定症例数の
範囲内でさらに実施予定
56
近接する消化管等のため粒子線治療が困難な患者を対象に悪性腫瘍
と消化管等との間隙確保を目的とした、放射線治療用吸収性組織ス
ペーサを当院が発案し、企業と協力しつつ主体的に開発を進めた。臨
床研究推進センターは、企業交渉、臨床試験結果の検討や保険適用に
関する支援を実施し、2018年12月に製造販売承認を取得、 2019年に
は保険収載され、粒子線治療前のスペーサ留置術が保険適用となり、
2023年9月からは、X線治療前のスペーサ留置術が保険適用となった。
クラス分類Ⅳ(高度管理医療機器)承認番号:23000BZX00381000)
鼻腔内の観察部位を変更する際の抜き差しの煩雑さを解消し、患部への挿入が容易となるよ
う、軟性鏡・硬性鏡両方の特長を備えもつことで医師の手技効率向上に寄与する耳鼻咽喉ビデ
オスコープを当院と企業とで共同開発し、2023年5月に医療機器認証を受けた。
クラス分類
クラスⅡ (特定保守管理医療機器)
医療機器認証番号
305AFBZX00046000」
分散型治験(DCT)体制整備・実施状況
・整形外科領域の医師主導治験:被験者2名に対してDCT(配送業者による患者宅への治験薬配送)を実施済み、予定症例数の
範囲内でさらに実施予定
56