よむ、つかう、まなぶ。
資料2-1:前回部会における主な指摘事項への対応(臨床研究中核病院の承認要件見直しについて) (36 ページ)
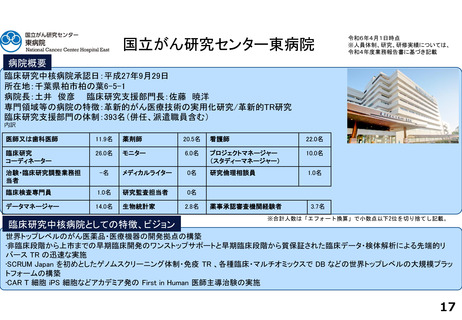
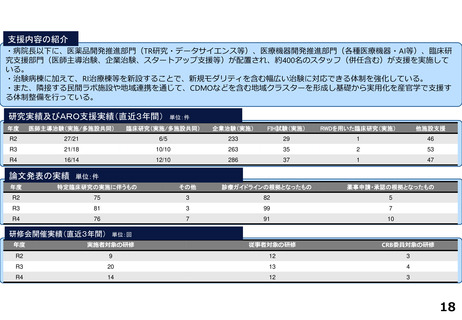
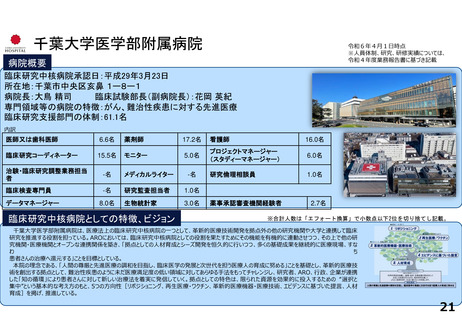
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第38回 11/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
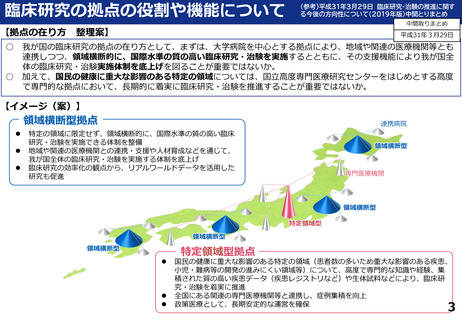
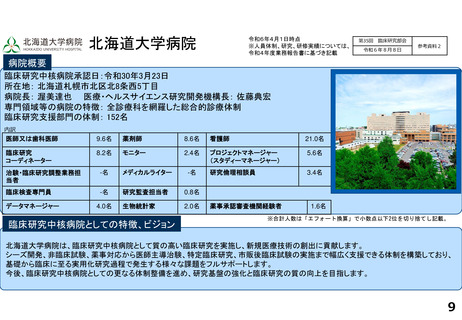
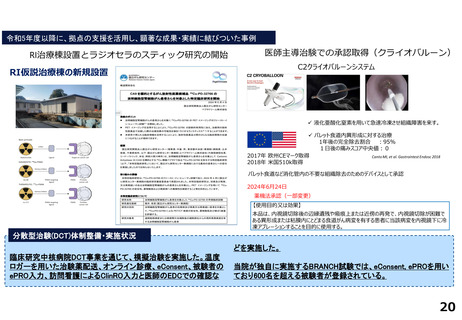
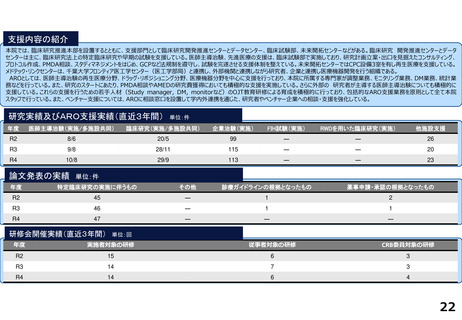
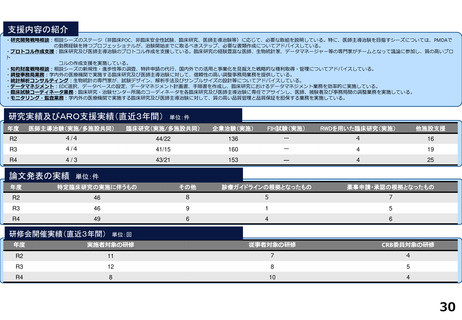
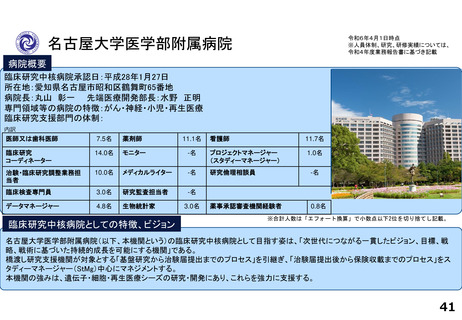
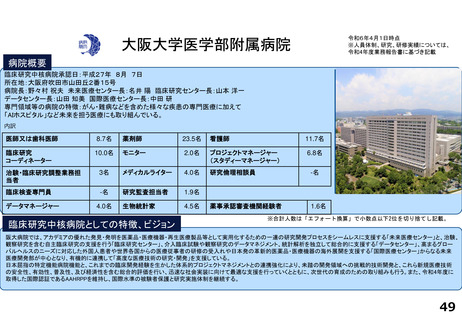
令和5年度以降に、拠点の支援を活用し、顕著な成果・実績に結びついた事例
臨床研究推進センターの企画・運営・実施支援により以下の医療の実用化及び高度医療の提供につながっています。
<薬事承認申請>
➢ 株式会社グレースイメージング(慶應発ベンチャー)が、汗中の乳酸値を非侵襲的かつリアルタイムに
測定するウェアラブルデバイスを、2024年3月7日に医療機器として承認申請を行った(図1)
(対象:NYHA I または II の心不全患者)
図1
<再生医療等>(再生医療等安全性確保法下の臨床研究または治験でFirst in Humanを達成したシーズ)
臨床研究
➢ ヒトiPS細胞由来神経前駆細胞(対象:亜急性期脊髄損傷)
➢ 同種間葉系幹細胞由来血小板様細胞★(対象:難治性皮膚潰瘍)
➢ ヒトiPS細胞由来角膜内皮代替細胞★(対象:水疱性角膜症)
治験
➢ ヒトiPS細胞由来心筋球★(対象:虚血性心疾患に伴う重症心不全)※企業治験にてFIH達成
★令和5年度までに慶應発ベンチャー主導の開発に移行しているシーズ(企業治験を実施中または計画中)
<医師主導治験>
➢ Clinical Innovation Network (CIN)事業から継続される肺動脈性肺高血圧症の患者レジストリを外部対照群とする多施設共同第Ⅱ相試験を計画し、
PMDAレジストリ活用相談・新薬審査部との合意形成の下、新規薬剤の適応症拡大に向けた医師主導治験を開始・支援している。
➢ 上皮系皮膚悪性腫瘍に対する抗PD-1抗体療法の医師主導による多施設共同第Ⅱ相臨床試験(2024年2月9日国内製造販売承認事項一部変更承認を取得)
<先進医療B>
➢ 水素ガス吸入療法
対象:心停止後症候群(院外における心停止後に院外又は救急外来において自己心拍が再開し、かつ、心原性心停止が推定されるものに限る。)
➢ イマチニブ経口投与及びペムブロリズマブ静脈内投与の併用療法
対象:進行期悪性黒色腫(KIT遺伝子変異を有するものであって、従来の治療法に抵抗性を有するものに限る)
<患者申出療養>
➢ リツキシマブ静脈内投与療法 対象:難治性天疱瘡(ステロイド抵抗性のもの又はステロイドを減量する過程で再燃したものに限る)
➢ トラスツズマブ エムタンシン静脈内投与療法 対象:乳房外パジェット病(HER2 が陽性であって、切除が困難な進行性のものでありかつトラスツズマブ静脈
内投与が行われたものに限る)
➢ 経皮的胸部悪性腫瘍凍結融解壊死療法 対象:肺悪性腫瘍、縦隔悪性腫瘍、胸膜悪性腫瘍又は胸壁悪性腫瘍
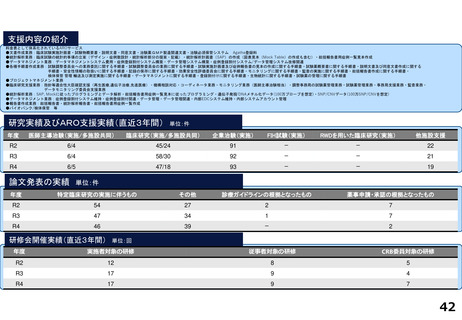
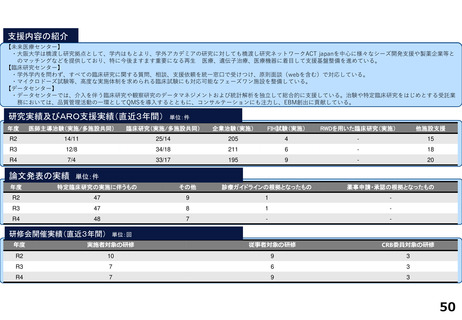
分散型治験(DCT)体制整備・実施状況
<実施例>
DCTは未実施であるが、企業治験、医師主導治験でオンライン診療(D to D with P)の実施可否を検討中である。
<システム整備状況>
オンライン診療システムMICIN社のMiROHAを医師主導治験で使用可能である。
36
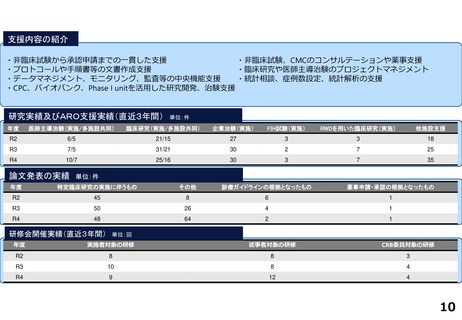
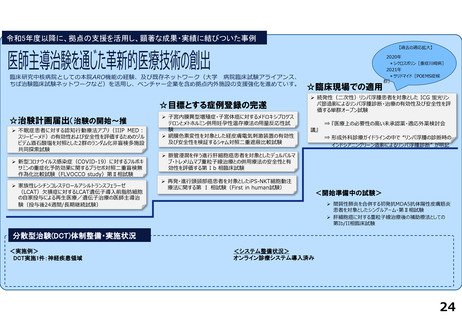
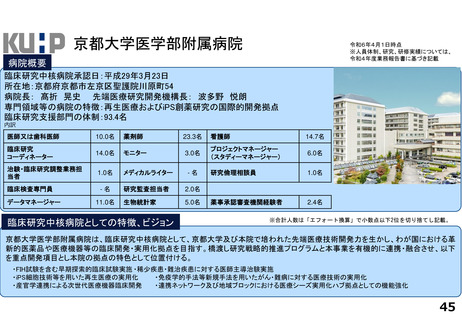
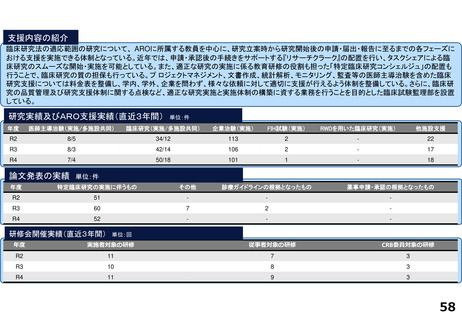
臨床研究推進センターの企画・運営・実施支援により以下の医療の実用化及び高度医療の提供につながっています。
<薬事承認申請>
➢ 株式会社グレースイメージング(慶應発ベンチャー)が、汗中の乳酸値を非侵襲的かつリアルタイムに
測定するウェアラブルデバイスを、2024年3月7日に医療機器として承認申請を行った(図1)
(対象:NYHA I または II の心不全患者)
図1
<再生医療等>(再生医療等安全性確保法下の臨床研究または治験でFirst in Humanを達成したシーズ)
臨床研究
➢ ヒトiPS細胞由来神経前駆細胞(対象:亜急性期脊髄損傷)
➢ 同種間葉系幹細胞由来血小板様細胞★(対象:難治性皮膚潰瘍)
➢ ヒトiPS細胞由来角膜内皮代替細胞★(対象:水疱性角膜症)
治験
➢ ヒトiPS細胞由来心筋球★(対象:虚血性心疾患に伴う重症心不全)※企業治験にてFIH達成
★令和5年度までに慶應発ベンチャー主導の開発に移行しているシーズ(企業治験を実施中または計画中)
<医師主導治験>
➢ Clinical Innovation Network (CIN)事業から継続される肺動脈性肺高血圧症の患者レジストリを外部対照群とする多施設共同第Ⅱ相試験を計画し、
PMDAレジストリ活用相談・新薬審査部との合意形成の下、新規薬剤の適応症拡大に向けた医師主導治験を開始・支援している。
➢ 上皮系皮膚悪性腫瘍に対する抗PD-1抗体療法の医師主導による多施設共同第Ⅱ相臨床試験(2024年2月9日国内製造販売承認事項一部変更承認を取得)
<先進医療B>
➢ 水素ガス吸入療法
対象:心停止後症候群(院外における心停止後に院外又は救急外来において自己心拍が再開し、かつ、心原性心停止が推定されるものに限る。)
➢ イマチニブ経口投与及びペムブロリズマブ静脈内投与の併用療法
対象:進行期悪性黒色腫(KIT遺伝子変異を有するものであって、従来の治療法に抵抗性を有するものに限る)
<患者申出療養>
➢ リツキシマブ静脈内投与療法 対象:難治性天疱瘡(ステロイド抵抗性のもの又はステロイドを減量する過程で再燃したものに限る)
➢ トラスツズマブ エムタンシン静脈内投与療法 対象:乳房外パジェット病(HER2 が陽性であって、切除が困難な進行性のものでありかつトラスツズマブ静脈
内投与が行われたものに限る)
➢ 経皮的胸部悪性腫瘍凍結融解壊死療法 対象:肺悪性腫瘍、縦隔悪性腫瘍、胸膜悪性腫瘍又は胸壁悪性腫瘍
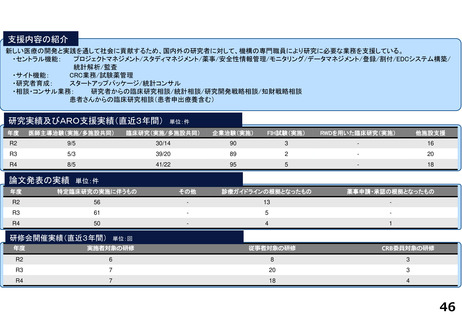
分散型治験(DCT)体制整備・実施状況
<実施例>
DCTは未実施であるが、企業治験、医師主導治験でオンライン診療(D to D with P)の実施可否を検討中である。
<システム整備状況>
オンライン診療システムMICIN社のMiROHAを医師主導治験で使用可能である。
36