よむ、つかう、まなぶ。
資料2-1:前回部会における主な指摘事項への対応(臨床研究中核病院の承認要件見直しについて) (38 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第38回 11/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
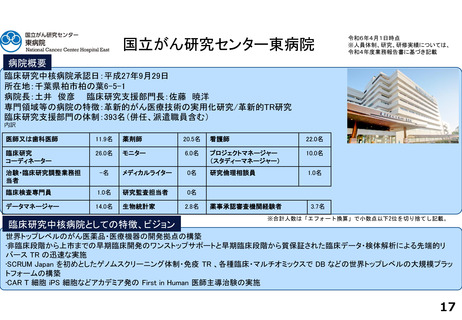
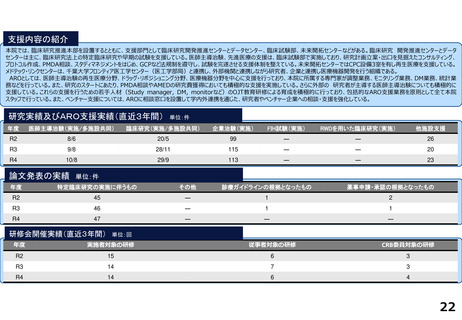
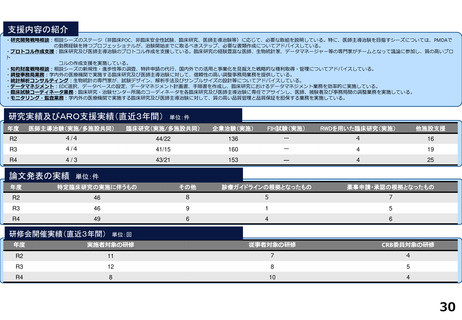
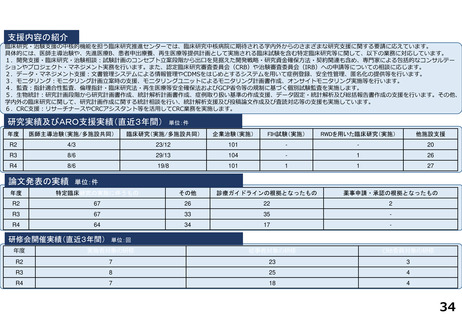
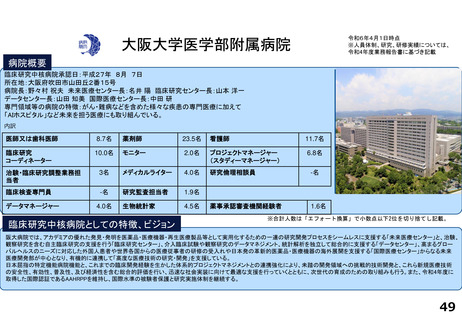
支援内容の紹介
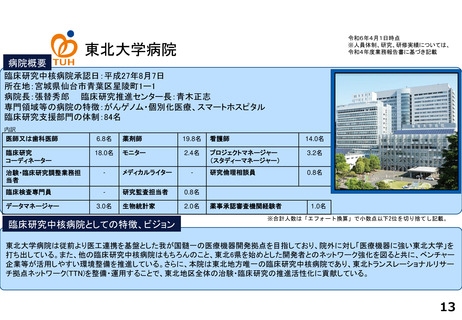
がん分野の多数の企業治験を実施するとともに、医師主導治験・特定臨床研究・先進医療・患者申出療養など多様な臨床研究につ
いて、試験計画、プロジェクトマネジメント、データ管理、モニタリング、統計解析、安全性情報管理、トランスレーショナル研
究支援など多くの機能を包括的に提供し、First in Human試験を含むすべてのphaseの臨床研究支援を行っている。また、機関内外
を対象とした臨床研究に関係する各種コンサルテーション・研修・倫理審査を行っている。
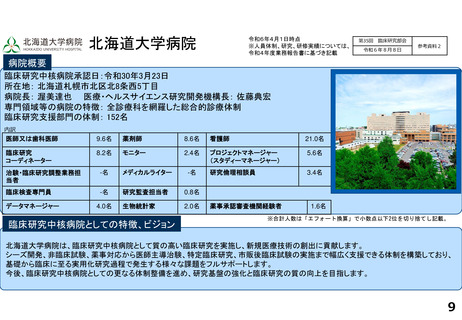
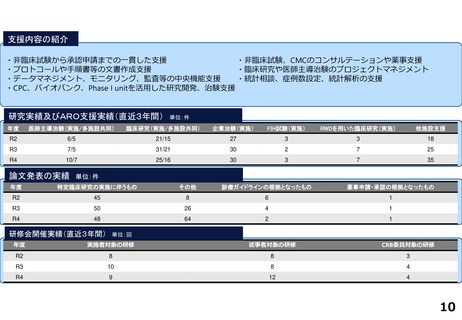
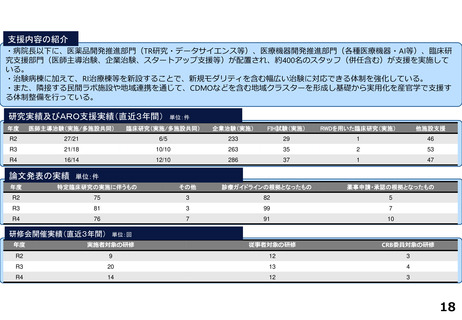
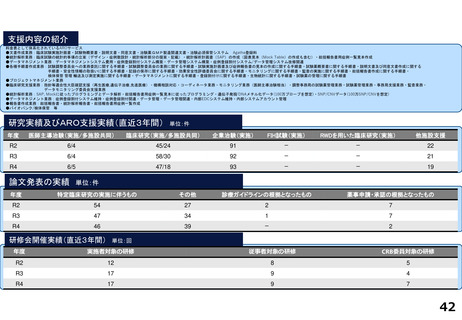
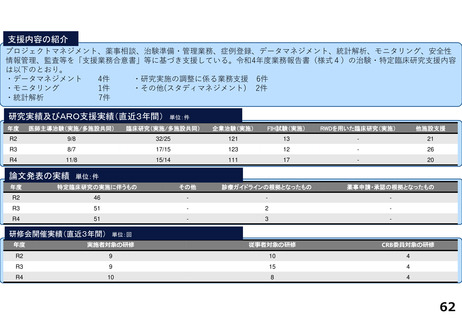
研究実績及びARO支援実績(直近3年間) 単位:件
年度
医師主導治験(実施/多施設共同)
臨床研究(実施/多施設共同)
企業治験(実施)
FIH試験(実施)
RWDを用いた臨床研究(実施)
他施設支援
R2
15/13
20/19
277
36
1
2816
R3
10/9
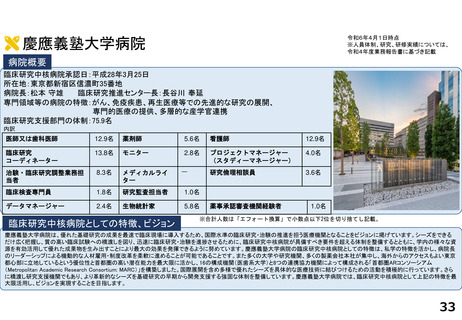
15/15
278
46
―
76
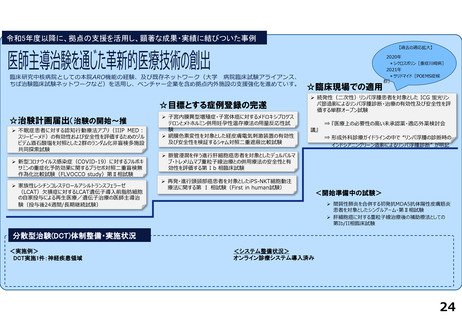
R4
9/8
15/17
274
51
―
84
論文発表の実績 単位:件
年度
特定臨床研究の実施に伴うもの
その他
診療ガイドラインの根拠となったもの
薬事申請・承認の根拠となったもの
R2
64
―
34
2
R3
59
―
47
3
R4
55
―
52
3
研修会開催実績(直近3年間)
単位:回
年度
実施者対象の研修
従事者対象の研修
CRB委員対象の研修
R2
12
3
21
R3
28
10
4
R4
25
13
5
38
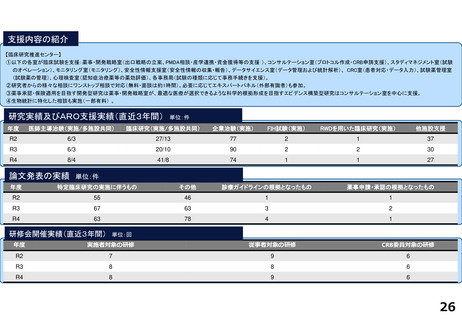
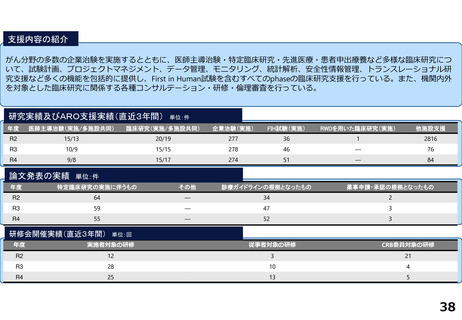
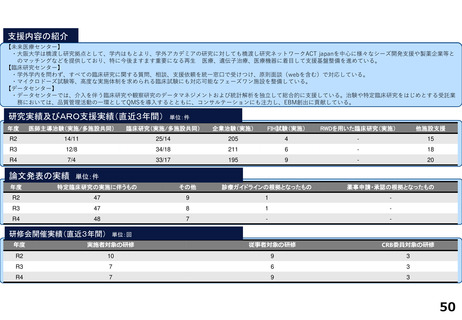
がん分野の多数の企業治験を実施するとともに、医師主導治験・特定臨床研究・先進医療・患者申出療養など多様な臨床研究につ
いて、試験計画、プロジェクトマネジメント、データ管理、モニタリング、統計解析、安全性情報管理、トランスレーショナル研
究支援など多くの機能を包括的に提供し、First in Human試験を含むすべてのphaseの臨床研究支援を行っている。また、機関内外
を対象とした臨床研究に関係する各種コンサルテーション・研修・倫理審査を行っている。
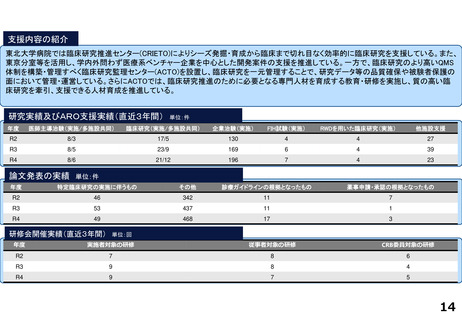
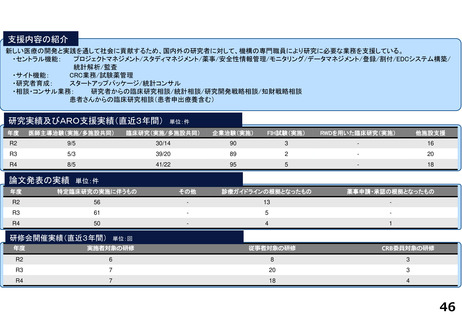
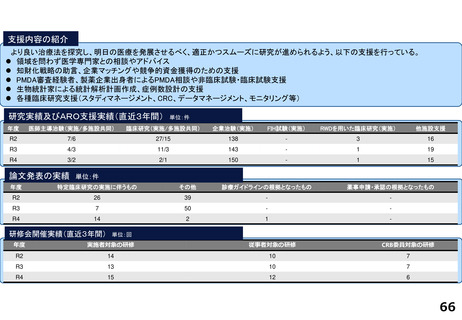
研究実績及びARO支援実績(直近3年間) 単位:件
年度
医師主導治験(実施/多施設共同)
臨床研究(実施/多施設共同)
企業治験(実施)
FIH試験(実施)
RWDを用いた臨床研究(実施)
他施設支援
R2
15/13
20/19
277
36
1
2816
R3
10/9
15/15
278
46
―
76
R4
9/8
15/17
274
51
―
84
論文発表の実績 単位:件
年度
特定臨床研究の実施に伴うもの
その他
診療ガイドラインの根拠となったもの
薬事申請・承認の根拠となったもの
R2
64
―
34
2
R3
59
―
47
3
R4
55
―
52
3
研修会開催実績(直近3年間)
単位:回
年度
実施者対象の研修
従事者対象の研修
CRB委員対象の研修
R2
12
3
21
R3
28
10
4
R4
25
13
5
38