よむ、つかう、まなぶ。
資料2-1:前回部会における主な指摘事項への対応(臨床研究中核病院の承認要件見直しについて) (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第38回 11/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
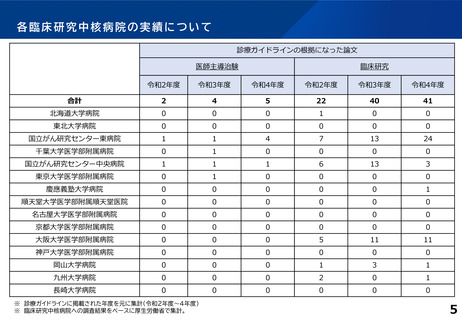
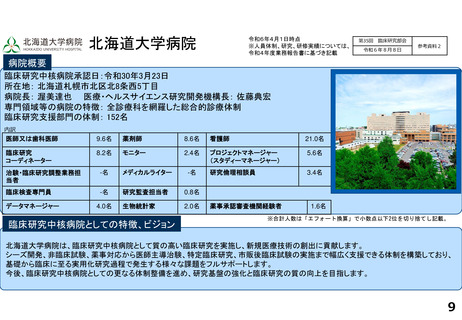
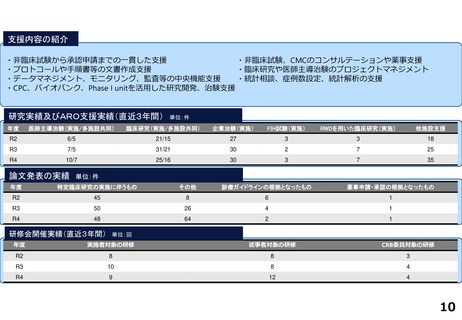
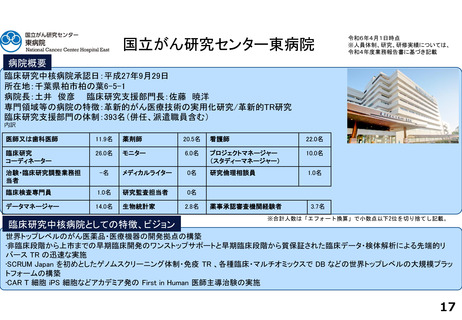
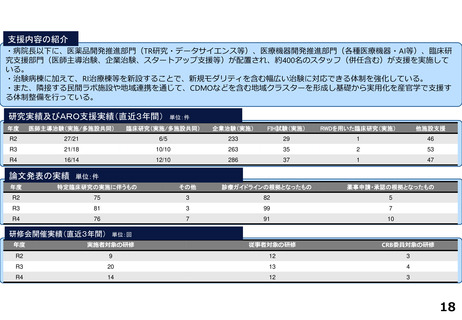
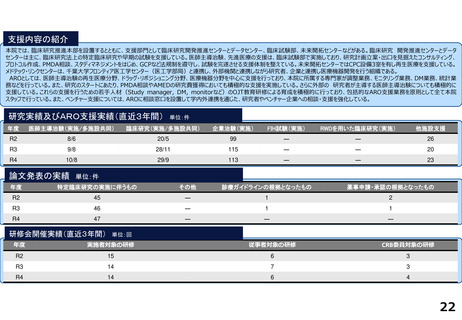
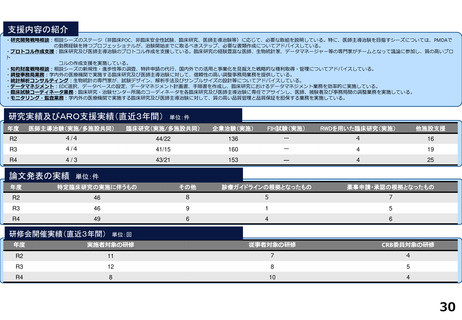
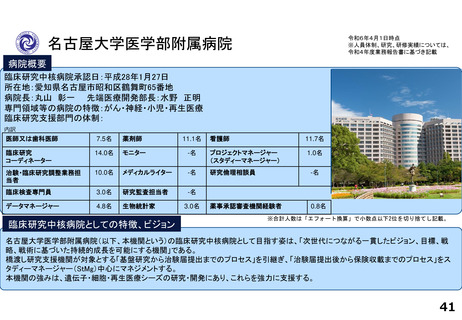
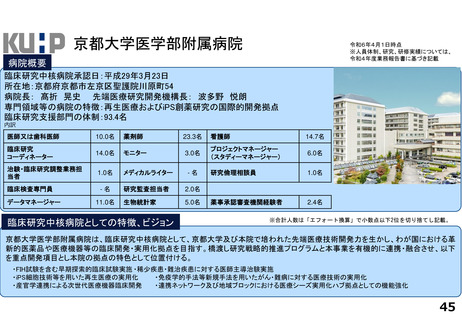
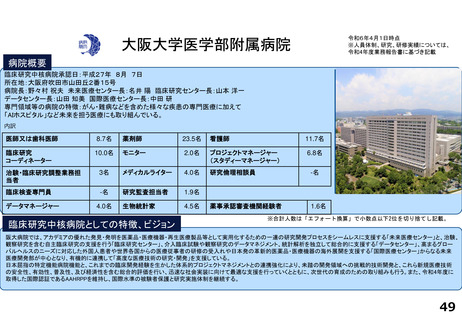
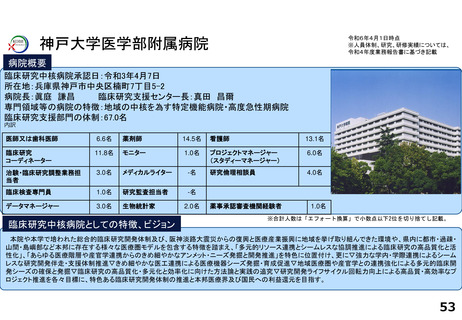
各臨床研究中核病院の実績について
薬事承認の根拠になった論文数
医師主導治験
臨床研究
令和2年度
令和3年度
令和4年度
令和2年度
令和3年度
令和4年度
合計
1
7
2
0
0
5
北海道大学病院
0
0
0
0
0
0
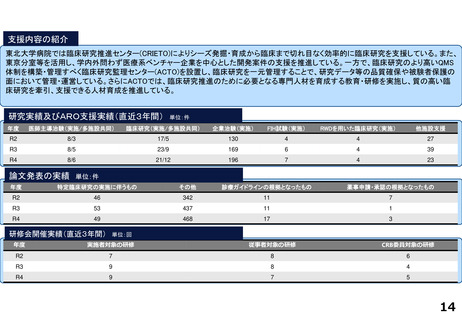
東北大学病院
0
0
0
0
0
0
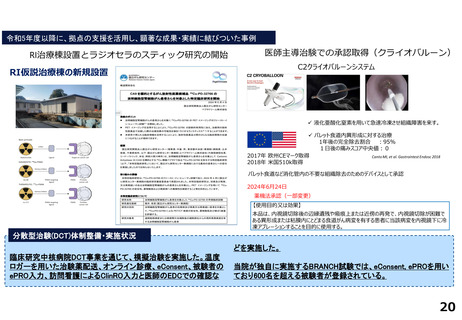
国立がん研究センター東病院
0
1
0
0
0
1
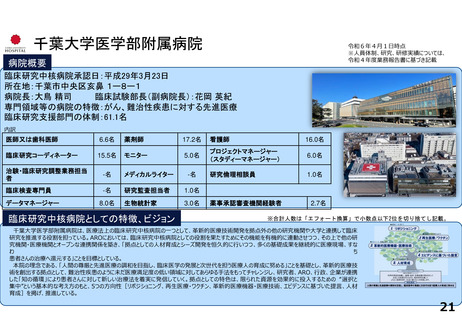
千葉大学医学部附属病院
1
0
0
0
0
0
国立がん研究センター中央病院
0
3
0
0
0
0
東京大学医学部附属病院
0
1
0
0
0
0
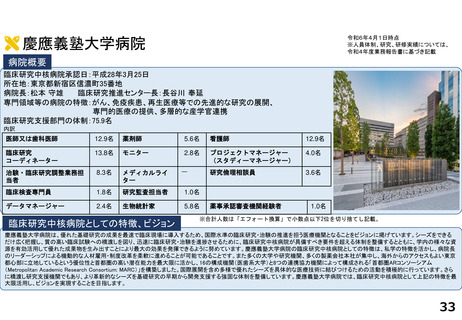
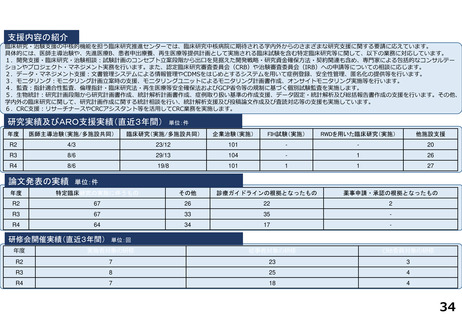
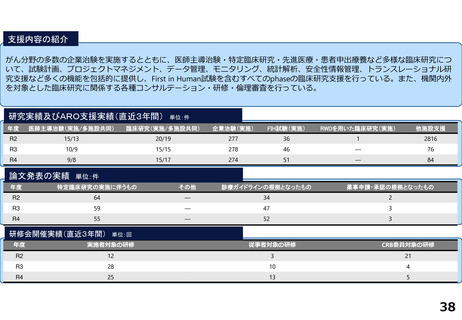
慶應義塾大学病院
0
0
1
0
0
0
順天堂大学医学部附属順天堂医院
0
0
0
0
0
0
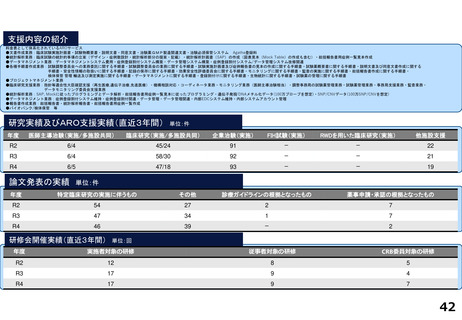
名古屋大学医学部附属病院
0
2
0
0
0
0
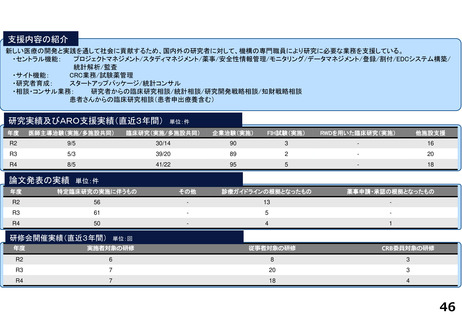
京都大学医学部附属病院
0
0
0
0
0
1
大阪大学医学部附属病院
0
0
1
0
0
3
神戸大学医学部附属病院
0
0
0
0
0
0
岡山大学病院
0
0
0
0
0
0
九州大学病院
0
0
0
0
0
0
長崎大学病院
0
0
0
0
0
0
※ 薬事承認された年度を元に集計(令和2年度~4年度)
※ 臨床研究中核病院への調査結果をベースに厚生労働省で集計。
6
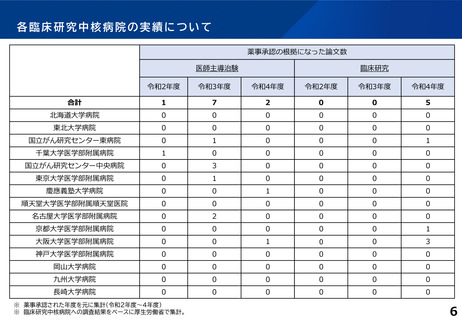
薬事承認の根拠になった論文数
医師主導治験
臨床研究
令和2年度
令和3年度
令和4年度
令和2年度
令和3年度
令和4年度
合計
1
7
2
0
0
5
北海道大学病院
0
0
0
0
0
0
東北大学病院
0
0
0
0
0
0
国立がん研究センター東病院
0
1
0
0
0
1
千葉大学医学部附属病院
1
0
0
0
0
0
国立がん研究センター中央病院
0
3
0
0
0
0
東京大学医学部附属病院
0
1
0
0
0
0
慶應義塾大学病院
0
0
1
0
0
0
順天堂大学医学部附属順天堂医院
0
0
0
0
0
0
名古屋大学医学部附属病院
0
2
0
0
0
0
京都大学医学部附属病院
0
0
0
0
0
1
大阪大学医学部附属病院
0
0
1
0
0
3
神戸大学医学部附属病院
0
0
0
0
0
0
岡山大学病院
0
0
0
0
0
0
九州大学病院
0
0
0
0
0
0
長崎大学病院
0
0
0
0
0
0
※ 薬事承認された年度を元に集計(令和2年度~4年度)
※ 臨床研究中核病院への調査結果をベースに厚生労働省で集計。
6