よむ、つかう、まなぶ。
令和3年度医療機器・再生医療等製品の自主回収一覧 (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190382_00011.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・再生医療等製品安全対策部会(令和4年度第1回 7/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
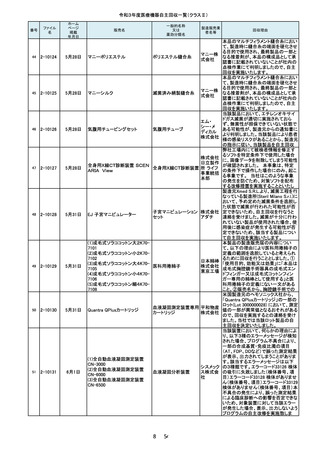
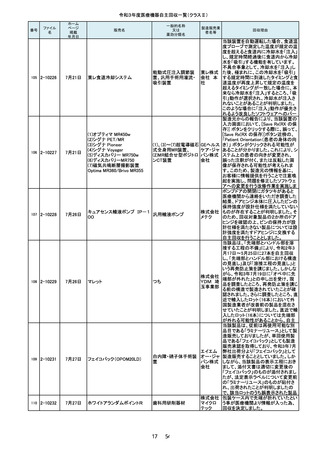
令和3年度医療機器自主回収一覧(クラスⅡ)
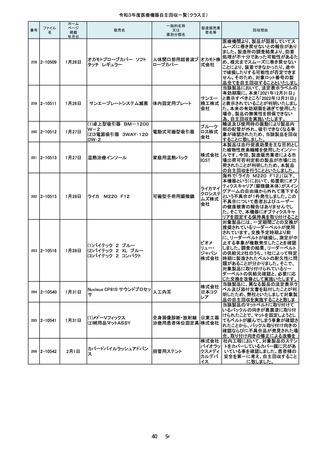
番号
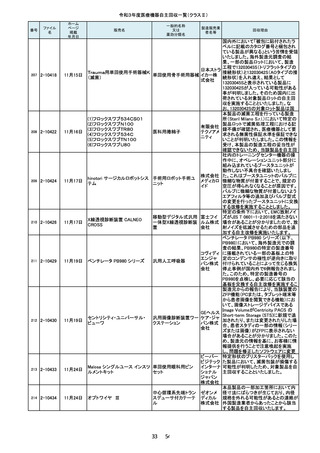
105
ファイル
名
2-10226
ホーム
ページ
掲載
年月日
一般的名称
又は
薬効分類名
販売名
製造販売業
者名等
7月21日
東レ食道冷却システム
能動式圧注入調節装
置、汎用手術用灌流・
吸引装置
東レ株式
会社 本
社
(1)、(3)~(7)超電導磁石
式全身用MR装置、
(2)MR組合せ型ポジトロ
ンCT装置
GEヘルス
ケア・ジャ
パン株式
会社
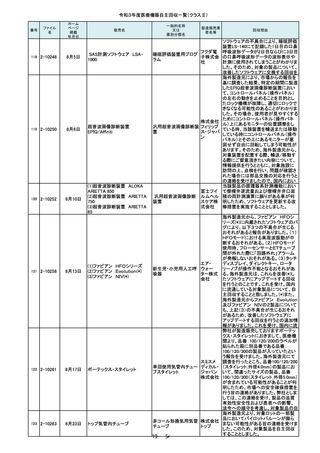
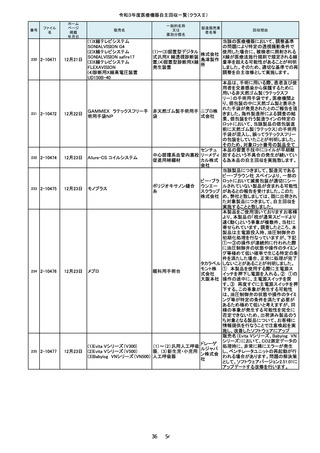
106
2-10227
7月21日
(1)オプティマ MR450w
(2)シグナ PET/MR
(3)シグナ Pioneer
(4)シグナ Voyager
(5)ディスカバリー MR750w
(6)ディスカバリーMR750
(7)磁気共鳴断層撮影装置
Optima MR360/Brivo MR355
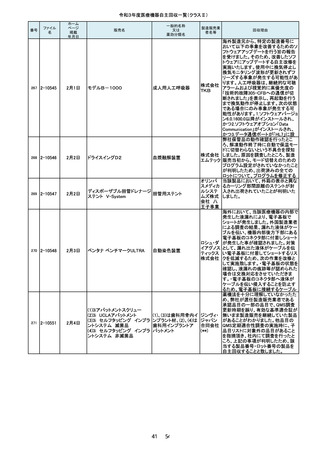
107
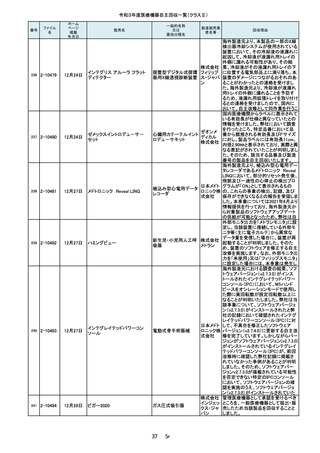
2-10228
7月26日
キュアセンス輸液ポンプ IP-1
汎用輸液ポンプ
00
株式会社
メテク
108
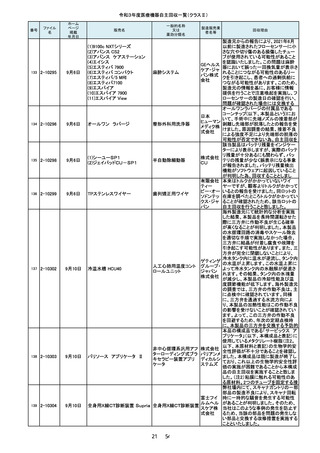
2-10229
7月26日
マレット
つち
株式会社
YDM 埼
玉事業部
109
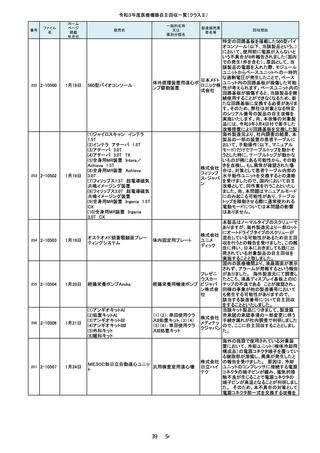
2-10231
7月27日
フェイコパック(OPOM20LD)
エイエム
白内障・硝子体手術装 オー・ジャ
置
パン株式
会社
110
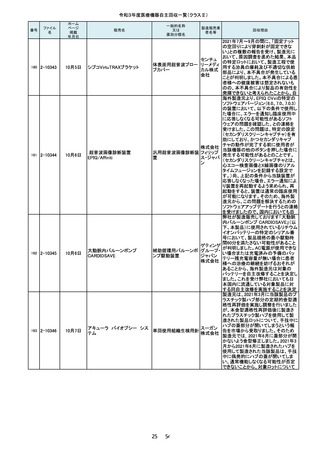
2-10232
7月27日
ホワイトアランダムポイントR
歯科用研削器材
17 / 54
株式会社
マイクロ
テック
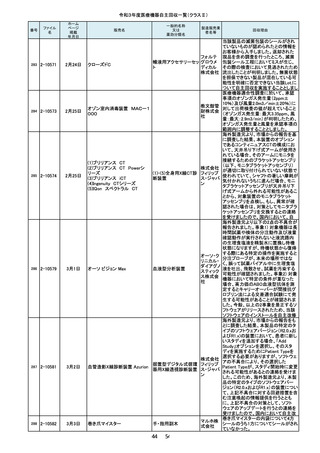
回収理由
当該装置を自動運転した場合、食道温
度プローブで測定した温度が規定の温
度を超えると食道内に冷却水を「注入」
し、規定時間経過後に食道内から冷却
水を「吸引」する機能を有しています。
不具合事象として、冷却水を「注入」し
た後、極まれに、この冷却水を「吸引」
する規定時間に到達したタイミングと食
道温度が再度上昇して規定の温度を
超えるタイミングが一致した場合に、本
来なら冷却水を「注入」するところ、「吸
引」動作が選択され、冷却水が注入さ
れないことがあることが判明しました。
このような場合に「注入」動作が優先さ
れるよう改良したソフトウェアへのバー
製造元からの報告により、当該装置の
入力画面において、[Save Rx(RX の保
存)] ボタンをクリックする際に、誤って、
[Save Rx(RX の保存)]ボタン近傍の、
「Patient Orientation(患者の身体の向
き)」 ボタンがクリックされる可能性が
あることが分かりました。これにより、シ
ステム上の患者の向きが変更され、
誤った注釈が付く、または反転した画
像が保存される可能性が考えられま
す。このため、製造元の情報を基に、
お客様に情報提供を行うことで注意喚
起を実施し、問題を修正したソフトウェ
アへの変更を行う改修作業を実施しま
ポンプドアの開閉にガタツキがあると
医療機関から連絡をいただき調査した
結果、ドアヒンジ本体に圧入したピンの
保持強度が設計仕様を満たしていない
ものが存在することが判明しました。そ
のため、回収対象製品の2か所のドア
ヒンジを確認の上、ピンの保持力が設
計仕様を満たさない製品については設
計強度を満たすドアヒンジに交換する
自主回収を行うこととしました。
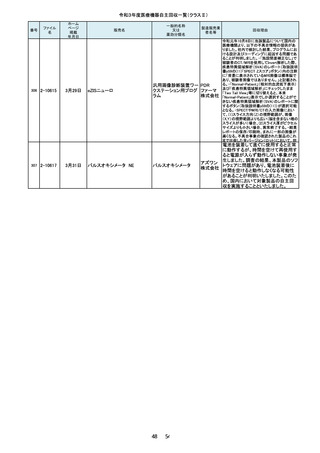
当該品は、「先端部とハンドル部を溶
接する工程の不備」により、令和2年3
月17日~5月25日に27本を自主回収
し、「先端部とハンドル部における構造
の見直し」及び「溶接工程の見直し」と
いう再発防止策を講じました。しかしな
がら、令和3年7月19日に「オペ中に先
端部が外れた」との申し出を受け、現
品を調査したところ、再発防止策を講じ
る前の構造で製造されていたことが確
認されました。さらに調査したところ、直
近で輸入したロット(16本)において外
国製造業者が改善前の製品を混在さ
せていたことが判明しました。直近で輸
入したロット(16本)については先端部
が外れる可能性があることから、自主
当該製品は、従前は再使用可能な別
品目である「ラミナーリユース」として製
造販売しておりましたが、単回使用製
品である「フェイコパック」としても製造
販売承認を取得しており、令和3年7月
弊社出荷分より「フェイコパック」として
製造販売することとしていました。しか
しながら、当該製品の表示工程におき
まして、添付文書は適切に変更後の
「フェイコパック」のものが添付されまし
たが、法定表示ラベルについて変更前
の「ラミナーリユース」のものが貼付さ
れ、出荷されたことが判明しましたの
で、該当ロットのうち誤表示された製品
包装ケース内で先端が折れていたとい
う事が医療機関より情報が入った為、
回収を決定しました。
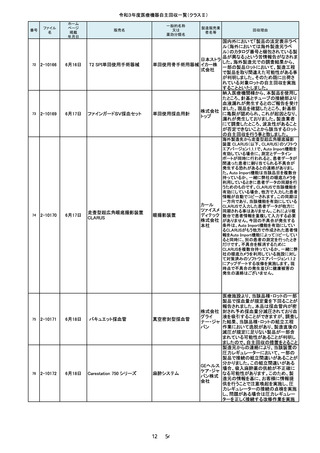
番号
105
ファイル
名
2-10226
ホーム
ページ
掲載
年月日
一般的名称
又は
薬効分類名
販売名
製造販売業
者名等
7月21日
東レ食道冷却システム
能動式圧注入調節装
置、汎用手術用灌流・
吸引装置
東レ株式
会社 本
社
(1)、(3)~(7)超電導磁石
式全身用MR装置、
(2)MR組合せ型ポジトロ
ンCT装置
GEヘルス
ケア・ジャ
パン株式
会社
106
2-10227
7月21日
(1)オプティマ MR450w
(2)シグナ PET/MR
(3)シグナ Pioneer
(4)シグナ Voyager
(5)ディスカバリー MR750w
(6)ディスカバリーMR750
(7)磁気共鳴断層撮影装置
Optima MR360/Brivo MR355
107
2-10228
7月26日
キュアセンス輸液ポンプ IP-1
汎用輸液ポンプ
00
株式会社
メテク
108
2-10229
7月26日
マレット
つち
株式会社
YDM 埼
玉事業部
109
2-10231
7月27日
フェイコパック(OPOM20LD)
エイエム
白内障・硝子体手術装 オー・ジャ
置
パン株式
会社
110
2-10232
7月27日
ホワイトアランダムポイントR
歯科用研削器材
17 / 54
株式会社
マイクロ
テック
回収理由
当該装置を自動運転した場合、食道温
度プローブで測定した温度が規定の温
度を超えると食道内に冷却水を「注入」
し、規定時間経過後に食道内から冷却
水を「吸引」する機能を有しています。
不具合事象として、冷却水を「注入」し
た後、極まれに、この冷却水を「吸引」
する規定時間に到達したタイミングと食
道温度が再度上昇して規定の温度を
超えるタイミングが一致した場合に、本
来なら冷却水を「注入」するところ、「吸
引」動作が選択され、冷却水が注入さ
れないことがあることが判明しました。
このような場合に「注入」動作が優先さ
れるよう改良したソフトウェアへのバー
製造元からの報告により、当該装置の
入力画面において、[Save Rx(RX の保
存)] ボタンをクリックする際に、誤って、
[Save Rx(RX の保存)]ボタン近傍の、
「Patient Orientation(患者の身体の向
き)」 ボタンがクリックされる可能性が
あることが分かりました。これにより、シ
ステム上の患者の向きが変更され、
誤った注釈が付く、または反転した画
像が保存される可能性が考えられま
す。このため、製造元の情報を基に、
お客様に情報提供を行うことで注意喚
起を実施し、問題を修正したソフトウェ
アへの変更を行う改修作業を実施しま
ポンプドアの開閉にガタツキがあると
医療機関から連絡をいただき調査した
結果、ドアヒンジ本体に圧入したピンの
保持強度が設計仕様を満たしていない
ものが存在することが判明しました。そ
のため、回収対象製品の2か所のドア
ヒンジを確認の上、ピンの保持力が設
計仕様を満たさない製品については設
計強度を満たすドアヒンジに交換する
自主回収を行うこととしました。
当該品は、「先端部とハンドル部を溶
接する工程の不備」により、令和2年3
月17日~5月25日に27本を自主回収
し、「先端部とハンドル部における構造
の見直し」及び「溶接工程の見直し」と
いう再発防止策を講じました。しかしな
がら、令和3年7月19日に「オペ中に先
端部が外れた」との申し出を受け、現
品を調査したところ、再発防止策を講じ
る前の構造で製造されていたことが確
認されました。さらに調査したところ、直
近で輸入したロット(16本)において外
国製造業者が改善前の製品を混在さ
せていたことが判明しました。直近で輸
入したロット(16本)については先端部
が外れる可能性があることから、自主
当該製品は、従前は再使用可能な別
品目である「ラミナーリユース」として製
造販売しておりましたが、単回使用製
品である「フェイコパック」としても製造
販売承認を取得しており、令和3年7月
弊社出荷分より「フェイコパック」として
製造販売することとしていました。しか
しながら、当該製品の表示工程におき
まして、添付文書は適切に変更後の
「フェイコパック」のものが添付されまし
たが、法定表示ラベルについて変更前
の「ラミナーリユース」のものが貼付さ
れ、出荷されたことが判明しましたの
で、該当ロットのうち誤表示された製品
包装ケース内で先端が折れていたとい
う事が医療機関より情報が入った為、
回収を決定しました。