よむ、つかう、まなぶ。
【資料No.1】★審査報告書 (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
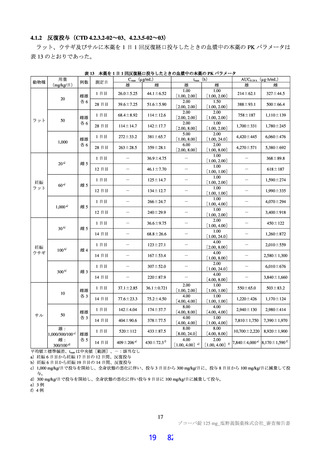
3.2
3.2.1
副次的薬理試験
各種受容体、イオンチャネル、トランスポーター及び酵素に及ぼす影響(CTD 4.2.1.2-01)
In vitro において、108 種の受容体、イオンチャネル、トランスポーター及び酵素に対する本薬
(100 μmol/L)の影響が検討され、50%以上の阻害活性が認められたのは、PDE4A1A、PDE4B1、PDE4C1、
PDE4D2、PDE7A、PDE7B、CCK2 受容体、ニコチン性 ACh 受容体サブユニット α1 及びアデノシントラ
ンスポーターであった。
また、50%以上の阻害活性が認められた上記 9 種及びペプチダーゼ 10 種(アンジオテンシン変換酵
素、カスパーゼ 2、キモトリプシン、カテプシン B、カテプシン D、カテプシン G、カテプシン L、好中
球エラスターゼ 2、HIV-1 プロテアーゼ及びトロンビン)に対する本薬(0.03~100 μmol/L)の影響が検
討され、50%以上の阻害活性が認められたのは、PDE4A1A、PDE4B1、PDE4C1、PDE4D2 及びアデノシ
ンの取込みであり、その IC50 はそれぞれ 63.2、69.1、75.7、73.4 及び 1.43 µmol/L であった。その他につ
いては、100 µmol/L まで 50%以上の阻害活性は認められなかった。
3.2.2
ヒト初代培養細胞に対する細胞毒性(CTD 4.2.1.2-02)
ヒト初代培養細胞(ヒト肝細胞、正常ヒト腎上皮混合細胞及びヒト末梢血 CD4+T 細胞)の増殖期及び
非増殖期に対する本薬(0.55~135 µmol/L)の細胞毒性が細胞中 ATP 量を指標として検討され、いずれ
の細胞においても CC50 は 135 µmol/L(72 µg/mL)超であった。
3.2.3
ヒト各種組織由来株化細胞に対する細胞毒性(CTD 4.2.1.2-03)
ヒト組織由来株化細胞[HepG2 細胞(ヒト肝細胞癌細胞)、HK-2 細胞(ヒト腎近位尿細管細胞)、
HEK293 細胞(ヒト胎児腎臓細胞)、SH-SY-5Y 細胞(ヒト神経芽腫細胞)、SK-N-SH 細胞(ヒト神経芽
腫細胞)、Jurkat 細胞(ヒト T 細胞白血病細胞)、E006AA-hT 細胞(ヒト前立腺癌細胞)、HUVEC 細胞
(ヒト血管内皮細胞)及び MRC-5 細胞(ヒト肺線維芽細胞)]に対する本薬(0.55~135 µmol/L)の細
胞毒性が細胞中 ATP 量を指標として検討され、いずれの細胞においても CC50 は 135 µmol/L(72 µg/mL)
超であった。
3.2.4
ヒト細胞に対するミトコンドリア毒性(CTD 4.2.1.2-04)
本薬(0.18~564 μmol/mL)存在下で、HepG2 細胞をグルコース又はガラクトース含有培地で培養した
ときの CC50 を、細胞中 ATP 量を指標にそれぞれ算出し、ミトコンドリア毒性が評価された11)。いずれ
の培地でも CC50 は同様であり、ミトコンドリア毒性は認められなかった。
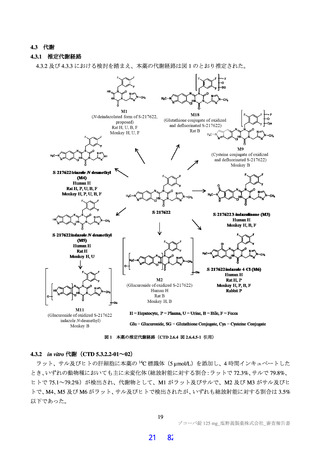
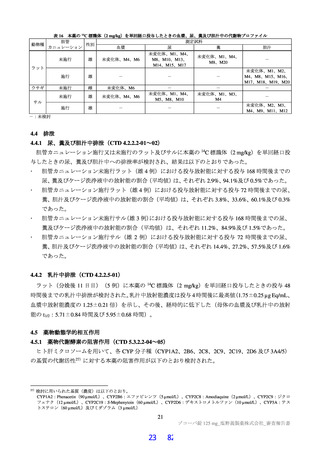
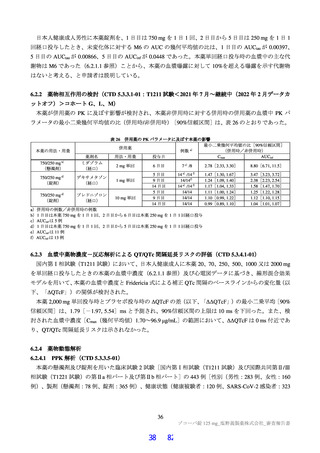
3.3
3.3.1
安全性薬理試験
中枢神経系に対する影響(CTD 4.2.1.3-01)
SD ラット(各群雄 6 例)に本薬 20、100 又は 1,000 mg/kg を単回経口投与し、一般症状及び神経行動
学的機能に対する本薬の影響が機能観察総合評価(FOB)法により検討された。その結果、1,000 mg/kg
投与群で糞量及び尿量の減少が認められたが、神経行動学的機能に関連する事象は認められず、中枢神
経系への影響を及ぼさないと申請者は判断している。
グルコース含有培地を用いた場合には解糖系を介した細胞内 ATP が産生されるため、被験薬のミトコンドリア毒性に抵抗性を示すの
に対し、ガラクトース含有培地を用いた場合では解糖系を介した細胞内 ATP 産生が制限されることにより、被験薬のミトコンドリア
毒性に感受性を示すことを利用し、各培地で培養したときの細胞毒性を比較することでミトコンドリア毒性が評価された。
11)
12
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
14 / 82
3.2.1
副次的薬理試験
各種受容体、イオンチャネル、トランスポーター及び酵素に及ぼす影響(CTD 4.2.1.2-01)
In vitro において、108 種の受容体、イオンチャネル、トランスポーター及び酵素に対する本薬
(100 μmol/L)の影響が検討され、50%以上の阻害活性が認められたのは、PDE4A1A、PDE4B1、PDE4C1、
PDE4D2、PDE7A、PDE7B、CCK2 受容体、ニコチン性 ACh 受容体サブユニット α1 及びアデノシントラ
ンスポーターであった。
また、50%以上の阻害活性が認められた上記 9 種及びペプチダーゼ 10 種(アンジオテンシン変換酵
素、カスパーゼ 2、キモトリプシン、カテプシン B、カテプシン D、カテプシン G、カテプシン L、好中
球エラスターゼ 2、HIV-1 プロテアーゼ及びトロンビン)に対する本薬(0.03~100 μmol/L)の影響が検
討され、50%以上の阻害活性が認められたのは、PDE4A1A、PDE4B1、PDE4C1、PDE4D2 及びアデノシ
ンの取込みであり、その IC50 はそれぞれ 63.2、69.1、75.7、73.4 及び 1.43 µmol/L であった。その他につ
いては、100 µmol/L まで 50%以上の阻害活性は認められなかった。
3.2.2
ヒト初代培養細胞に対する細胞毒性(CTD 4.2.1.2-02)
ヒト初代培養細胞(ヒト肝細胞、正常ヒト腎上皮混合細胞及びヒト末梢血 CD4+T 細胞)の増殖期及び
非増殖期に対する本薬(0.55~135 µmol/L)の細胞毒性が細胞中 ATP 量を指標として検討され、いずれ
の細胞においても CC50 は 135 µmol/L(72 µg/mL)超であった。
3.2.3
ヒト各種組織由来株化細胞に対する細胞毒性(CTD 4.2.1.2-03)
ヒト組織由来株化細胞[HepG2 細胞(ヒト肝細胞癌細胞)、HK-2 細胞(ヒト腎近位尿細管細胞)、
HEK293 細胞(ヒト胎児腎臓細胞)、SH-SY-5Y 細胞(ヒト神経芽腫細胞)、SK-N-SH 細胞(ヒト神経芽
腫細胞)、Jurkat 細胞(ヒト T 細胞白血病細胞)、E006AA-hT 細胞(ヒト前立腺癌細胞)、HUVEC 細胞
(ヒト血管内皮細胞)及び MRC-5 細胞(ヒト肺線維芽細胞)]に対する本薬(0.55~135 µmol/L)の細
胞毒性が細胞中 ATP 量を指標として検討され、いずれの細胞においても CC50 は 135 µmol/L(72 µg/mL)
超であった。
3.2.4
ヒト細胞に対するミトコンドリア毒性(CTD 4.2.1.2-04)
本薬(0.18~564 μmol/mL)存在下で、HepG2 細胞をグルコース又はガラクトース含有培地で培養した
ときの CC50 を、細胞中 ATP 量を指標にそれぞれ算出し、ミトコンドリア毒性が評価された11)。いずれ
の培地でも CC50 は同様であり、ミトコンドリア毒性は認められなかった。
3.3
3.3.1
安全性薬理試験
中枢神経系に対する影響(CTD 4.2.1.3-01)
SD ラット(各群雄 6 例)に本薬 20、100 又は 1,000 mg/kg を単回経口投与し、一般症状及び神経行動
学的機能に対する本薬の影響が機能観察総合評価(FOB)法により検討された。その結果、1,000 mg/kg
投与群で糞量及び尿量の減少が認められたが、神経行動学的機能に関連する事象は認められず、中枢神
経系への影響を及ぼさないと申請者は判断している。
グルコース含有培地を用いた場合には解糖系を介した細胞内 ATP が産生されるため、被験薬のミトコンドリア毒性に抵抗性を示すの
に対し、ガラクトース含有培地を用いた場合では解糖系を介した細胞内 ATP 産生が制限されることにより、被験薬のミトコンドリア
毒性に感受性を示すことを利用し、各培地で培養したときの細胞毒性を比較することでミトコンドリア毒性が評価された。
11)
12
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
14 / 82