よむ、つかう、まなぶ。
【資料No.1】★審査報告書 (55 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
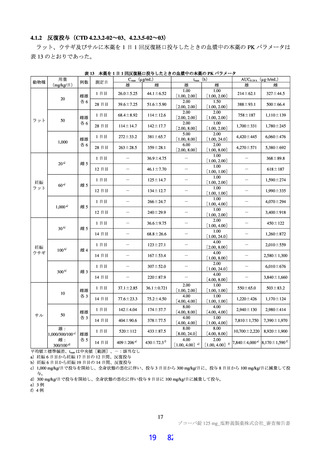
有効性について、主要評価項目は SARS-CoV-2 による感染症の 12 症状合計スコアの治験薬投与開始
(Day 1)から 120 時間(Day 6)までの単位時間当たりの変化量57)及び Day 4 における SARS-CoV-2 の
ウイルス力価のベースラインからの変化量の co-primary endpoint とされた。結果は表 35 のとおりであ
り、事前に規定された本試験の成功基準は満たさなかった。
表 35
主要評価項目の結果(第Ⅱb 相パート:ITT1 集団)
本薬 375/125 mg 群
本薬 750/250 mg 群
プラセボ群
(114 例)
(116 例)
(111 例)
12 症状合計スコアの治験薬投与開始(Day 1)から 120 時
-5.95±4.02
-5.42±3.70
-4.92±3.25
間(Day 6)までの単位時間当たりの変化量
(109 例)a)
(113 例)a)
(110 例)a)
プラセボ群との群間差[95%信頼区間]b)
-0.04[-0.62, 0.53]
-0.24[-0.83, 0.34]
-
0.4171
p 値 b)c)
-
Day 4 に お け る SARS-CoV-2 の ウ イ ル ス 力 価
-1.69±0.84
-1.43±0.83
-1.06±0.99
(log10 TCID50/mL)のベースラインからの変化量 d)
(106 例)a)
(112 例)a)
(107 例)a)
プラセボ群との群間差[95%信頼区間]e)
-0.41[-0.51, -0.31] -0.41[-0.51, -0.31]
-
p 値 c)e)
<0.0001
-
平均値±標準偏差
a)ベースライン又は投与開始後のスコアが得られなかった被験者及び Day 4 のウイルス力価が得られなかった被験者は解析から除外さ
れた。
b)ベースラインの 12 症状合計スコア、SARS-CoV-2 による感染症の症状発現からランダム化までの時間(72 時間未満、72 時間以上)、
SARS-CoV-2 による感染症に対するワクチン接種歴の有無を共変量とした ANCOVA(Analysis of Covariance)モデル
c)試験全体の有意水準は両側 5%。仮説検定の多重性の調整方法として、本薬 375/125 mg 群とプラセボ群の比較において 2 つの主要評
価項目で共に統計的に有意であった場合に、本薬 750/250 mg 群とプラセボ群の比較が実施される計画とされた。
d)検出下限(1.1 log10 TCID50/mL)未満の場合は、1.1 log10 TCID50/mL とされた。
e)ベースラインの SARS-CoV-2 のウイルス力価、SARS-CoV-2 による感染症の症状発現からランダム化までの時間(72 時間未満、72 時
間以上)、SARS-CoV-2 による感染症に対するワクチン接種歴の有無を共変量とした ANCOVA モデル
なお、12 症状合計スコア及びそのベースラインからの変化量の推移は図 5、12 症状の各スコアの推移
は図 6 のとおりであった。
SARS-CoV-2 による感染症の 12 症状(①倦怠感又は疲労感、②筋肉痛又は体の痛み、③頭痛、④悪寒又は発汗、⑤熱っぽさ又は発熱、
⑥鼻水又は鼻づまり、⑦喉の痛み、⑧咳、⑨息切れ(呼吸困難)、⑩吐き気、⑪嘔吐、⑫下痢)の各症状を 4 段階(0:なし、1:軽度、
2:中等度、3:重度)で被験者が評価したものを合計した 12 症状合計スコアについて、各時点のベースラインからの変化量について
治験薬投与開始(Day 1)から 120 時間(Day 6)までの AUC を台形法で計算し、AUC 算出時の評価期間(単位:時間)で割った値。
57)
53
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
55 / 82
(Day 1)から 120 時間(Day 6)までの単位時間当たりの変化量57)及び Day 4 における SARS-CoV-2 の
ウイルス力価のベースラインからの変化量の co-primary endpoint とされた。結果は表 35 のとおりであ
り、事前に規定された本試験の成功基準は満たさなかった。
表 35
主要評価項目の結果(第Ⅱb 相パート:ITT1 集団)
本薬 375/125 mg 群
本薬 750/250 mg 群
プラセボ群
(114 例)
(116 例)
(111 例)
12 症状合計スコアの治験薬投与開始(Day 1)から 120 時
-5.95±4.02
-5.42±3.70
-4.92±3.25
間(Day 6)までの単位時間当たりの変化量
(109 例)a)
(113 例)a)
(110 例)a)
プラセボ群との群間差[95%信頼区間]b)
-0.04[-0.62, 0.53]
-0.24[-0.83, 0.34]
-
0.4171
p 値 b)c)
-
Day 4 に お け る SARS-CoV-2 の ウ イ ル ス 力 価
-1.69±0.84
-1.43±0.83
-1.06±0.99
(log10 TCID50/mL)のベースラインからの変化量 d)
(106 例)a)
(112 例)a)
(107 例)a)
プラセボ群との群間差[95%信頼区間]e)
-0.41[-0.51, -0.31] -0.41[-0.51, -0.31]
-
p 値 c)e)
<0.0001
-
平均値±標準偏差
a)ベースライン又は投与開始後のスコアが得られなかった被験者及び Day 4 のウイルス力価が得られなかった被験者は解析から除外さ
れた。
b)ベースラインの 12 症状合計スコア、SARS-CoV-2 による感染症の症状発現からランダム化までの時間(72 時間未満、72 時間以上)、
SARS-CoV-2 による感染症に対するワクチン接種歴の有無を共変量とした ANCOVA(Analysis of Covariance)モデル
c)試験全体の有意水準は両側 5%。仮説検定の多重性の調整方法として、本薬 375/125 mg 群とプラセボ群の比較において 2 つの主要評
価項目で共に統計的に有意であった場合に、本薬 750/250 mg 群とプラセボ群の比較が実施される計画とされた。
d)検出下限(1.1 log10 TCID50/mL)未満の場合は、1.1 log10 TCID50/mL とされた。
e)ベースラインの SARS-CoV-2 のウイルス力価、SARS-CoV-2 による感染症の症状発現からランダム化までの時間(72 時間未満、72 時
間以上)、SARS-CoV-2 による感染症に対するワクチン接種歴の有無を共変量とした ANCOVA モデル
なお、12 症状合計スコア及びそのベースラインからの変化量の推移は図 5、12 症状の各スコアの推移
は図 6 のとおりであった。
SARS-CoV-2 による感染症の 12 症状(①倦怠感又は疲労感、②筋肉痛又は体の痛み、③頭痛、④悪寒又は発汗、⑤熱っぽさ又は発熱、
⑥鼻水又は鼻づまり、⑦喉の痛み、⑧咳、⑨息切れ(呼吸困難)、⑩吐き気、⑪嘔吐、⑫下痢)の各症状を 4 段階(0:なし、1:軽度、
2:中等度、3:重度)で被験者が評価したものを合計した 12 症状合計スコアについて、各時点のベースラインからの変化量について
治験薬投与開始(Day 1)から 120 時間(Day 6)までの AUC を台形法で計算し、AUC 算出時の評価期間(単位:時間)で割った値。
57)
53
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
55 / 82