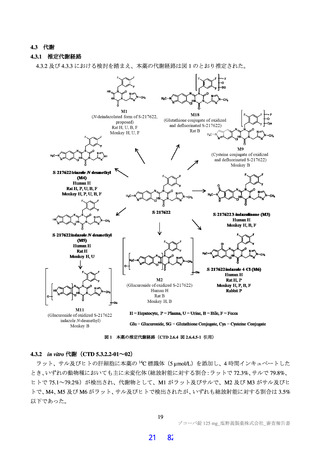
よむ、つかう、まなぶ。
【資料No.1】★審査報告書 (59 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
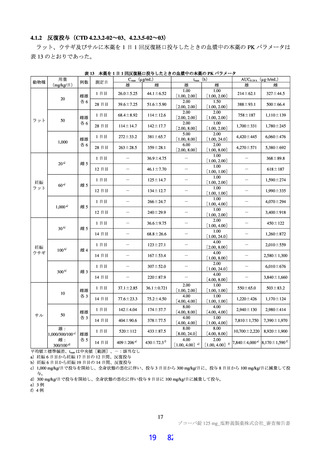
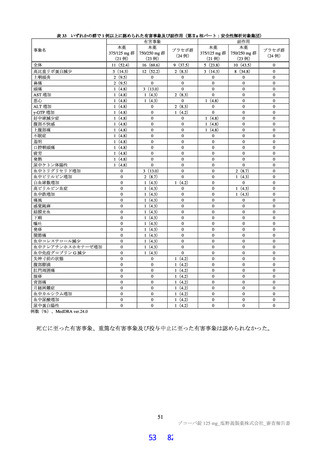
表 36
本薬群で 1 例以上に認められた有害事象及び副作用(第Ⅱb 相パート:安全性解析対象集団)
有害事象
副作用
本薬
本薬
本薬
本薬
事象名
プラセボ群
375/125 mg 群 750/250 mg 群
375/125 mg 群 750/250 mg 群
(141 例)
(140 例)
(140 例)
(140 例)
(140 例)
全体
48(34.3)
60(42.9)
44(31.2)
19(13.6)
31(22.1)
高比重リポ蛋白減少
31(22.1)
40(28.6)
5(3.5)
13(9.3)
22(15.7)
0
頭痛
3(2.1)
3(2.1)
1(0.7)
1(0.7)
下痢
2(1.4)
3(2.1)
1(0.7)
1(0.7)
2(1.4)
発疹
2(1.4)
1(0.7)
3(2.1)
1(0.7)
1(0.7)
0
ALT 増加
2(1.4)
1(0.7)
1(0.7)
1(0.7)
0
0
0
AST 増加
2(1.4)
1(0.7)
血中トリグリセリド増加
1(0.7)
9(6.4)
1(0.7)
1(0.7)
1(0.7)
0
0
背部痛
1(0.7)
3(2.1)
1(0.7)
悪心
1(0.7)
2(1.4)
1(0.7)
1(0.7)
2(1.4)
血中ビリルビン増加
1(0.7)
2(1.4)
1(0.7)
1(0.7)
1(0.7)
0
血中鉄増加
1(0.7)
1(0.7)
1(0.7)
1(0.7)
0
0
0
不眠症
1(0.7)
1(0.7)
0
0
0
嘔吐
1(0.7)
1(0.7)
0
0
動悸
1(0.7)
1(0.7)
1(0.7)
0
0
湿疹
1(0.7)
1(0.7)
1(0.7)
0
0
0
副鼻腔炎
1(0.7)
1(0.7)
0
0
0
0
膀胱炎
1(0.7)
0
0
0
0
喀血
1(0.7)
0
0
0
0
腹部不快感
1(0.7)
0
0
0
0
便秘
1(0.7)
0
0
0
0
関節痛
1(0.7)
0
0
0
0
四肢痛
1(0.7)
0
0
0
0
胸痛
1(0.7)
0
0
0
0
血中乳酸脱水素酵素増加
1(0.7)
0
0
0
0
尿中ブドウ糖陽性
1(0.7)
0
0
0
0
低比重リポ蛋白増加
1(0.7)
0
0
0
0
顎の骨折
1(0.7)
0
0
0
0
皮膚擦過傷
1(0.7)
0
0
0
脂質異常症
3(2.1)
3(2.1)
0
0
0
0
口腔ヘルペス
2(1.4)
0
0
0
0
季節性アレルギー
2(1.4)
0
0
感覚鈍麻
1(0.7)
2(1.4)
1(0.7)
0
0
0
上咽頭炎
1(0.7)
1(0.7)
0
0
0
鼻出血
1(0.7)
1(0.7)
0
0
0
胃腸障害
1(0.7)
1(0.7)
0
0
0
皮膚乾燥
1(0.7)
1(0.7)
0
0
0
椎間板突出
1(0.7)
1(0.7)
0
0
0
そう痒症
1(0.7)
1(0.7)
0
0
0
血中尿酸増加
1(0.7)
1(0.7)
0
0
0
肝酵素上昇
1(0.7)
1(0.7)
0
0
0
0
レンサ球菌感染
1(0.7)
0
0
0
0
胃食道逆流性疾患
1(0.7)
0
0
0
0
筋肉痛
1(0.7)
0
0
0
0
抱合ビリルビン増加
1(0.7)
0
0
0
0
血中コレステロール減少
1(0.7)
例数(%)、MedDRA ver.24.0
プラセボ群
(141 例)
7(5.0)
0
0
0
0
1(0.7)
0
0
0
1(0.7)
1(0.7)
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
死亡に至った有害事象は認められなかった。
重篤な有害事象は、プラセボ群 2 例(胸椎骨折及び顔面麻痺各 1 例)に認められ、いずれも治験薬と
の因果関係は否定され、転帰は軽快又は回復であった。
投与中止に至った有害事象は、本薬 375/125 mg 群 2 例[湿疹、悪心及び頭痛各 1 例(重複あり)]に
認められ、いずれも治験薬との因果関係はありとされ、転帰は回復であった。
57
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
59 / 82
本薬群で 1 例以上に認められた有害事象及び副作用(第Ⅱb 相パート:安全性解析対象集団)
有害事象
副作用
本薬
本薬
本薬
本薬
事象名
プラセボ群
375/125 mg 群 750/250 mg 群
375/125 mg 群 750/250 mg 群
(141 例)
(140 例)
(140 例)
(140 例)
(140 例)
全体
48(34.3)
60(42.9)
44(31.2)
19(13.6)
31(22.1)
高比重リポ蛋白減少
31(22.1)
40(28.6)
5(3.5)
13(9.3)
22(15.7)
0
頭痛
3(2.1)
3(2.1)
1(0.7)
1(0.7)
下痢
2(1.4)
3(2.1)
1(0.7)
1(0.7)
2(1.4)
発疹
2(1.4)
1(0.7)
3(2.1)
1(0.7)
1(0.7)
0
ALT 増加
2(1.4)
1(0.7)
1(0.7)
1(0.7)
0
0
0
AST 増加
2(1.4)
1(0.7)
血中トリグリセリド増加
1(0.7)
9(6.4)
1(0.7)
1(0.7)
1(0.7)
0
0
背部痛
1(0.7)
3(2.1)
1(0.7)
悪心
1(0.7)
2(1.4)
1(0.7)
1(0.7)
2(1.4)
血中ビリルビン増加
1(0.7)
2(1.4)
1(0.7)
1(0.7)
1(0.7)
0
血中鉄増加
1(0.7)
1(0.7)
1(0.7)
1(0.7)
0
0
0
不眠症
1(0.7)
1(0.7)
0
0
0
嘔吐
1(0.7)
1(0.7)
0
0
動悸
1(0.7)
1(0.7)
1(0.7)
0
0
湿疹
1(0.7)
1(0.7)
1(0.7)
0
0
0
副鼻腔炎
1(0.7)
1(0.7)
0
0
0
0
膀胱炎
1(0.7)
0
0
0
0
喀血
1(0.7)
0
0
0
0
腹部不快感
1(0.7)
0
0
0
0
便秘
1(0.7)
0
0
0
0
関節痛
1(0.7)
0
0
0
0
四肢痛
1(0.7)
0
0
0
0
胸痛
1(0.7)
0
0
0
0
血中乳酸脱水素酵素増加
1(0.7)
0
0
0
0
尿中ブドウ糖陽性
1(0.7)
0
0
0
0
低比重リポ蛋白増加
1(0.7)
0
0
0
0
顎の骨折
1(0.7)
0
0
0
0
皮膚擦過傷
1(0.7)
0
0
0
脂質異常症
3(2.1)
3(2.1)
0
0
0
0
口腔ヘルペス
2(1.4)
0
0
0
0
季節性アレルギー
2(1.4)
0
0
感覚鈍麻
1(0.7)
2(1.4)
1(0.7)
0
0
0
上咽頭炎
1(0.7)
1(0.7)
0
0
0
鼻出血
1(0.7)
1(0.7)
0
0
0
胃腸障害
1(0.7)
1(0.7)
0
0
0
皮膚乾燥
1(0.7)
1(0.7)
0
0
0
椎間板突出
1(0.7)
1(0.7)
0
0
0
そう痒症
1(0.7)
1(0.7)
0
0
0
血中尿酸増加
1(0.7)
1(0.7)
0
0
0
肝酵素上昇
1(0.7)
1(0.7)
0
0
0
0
レンサ球菌感染
1(0.7)
0
0
0
0
胃食道逆流性疾患
1(0.7)
0
0
0
0
筋肉痛
1(0.7)
0
0
0
0
抱合ビリルビン増加
1(0.7)
0
0
0
0
血中コレステロール減少
1(0.7)
例数(%)、MedDRA ver.24.0
プラセボ群
(141 例)
7(5.0)
0
0
0
0
1(0.7)
0
0
0
1(0.7)
1(0.7)
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
死亡に至った有害事象は認められなかった。
重篤な有害事象は、プラセボ群 2 例(胸椎骨折及び顔面麻痺各 1 例)に認められ、いずれも治験薬と
の因果関係は否定され、転帰は軽快又は回復であった。
投与中止に至った有害事象は、本薬 375/125 mg 群 2 例[湿疹、悪心及び頭痛各 1 例(重複あり)]に
認められ、いずれも治験薬との因果関係はありとされ、転帰は回復であった。
57
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
59 / 82