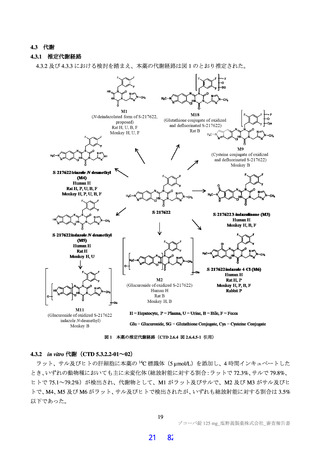
よむ、つかう、まなぶ。
【資料No.1】★審査報告書 (38 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
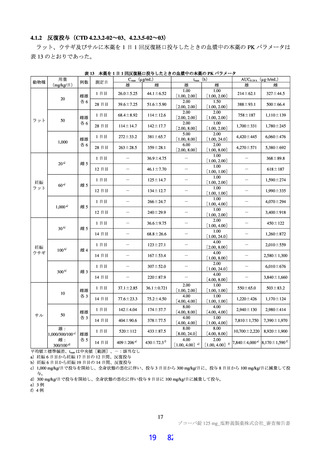
日本人健康成人男性に本薬錠剤を、1 日目は 750 mg を 1 日 1 回、2 日目から 5 日目は 250 mg を 1 日 1
回経口投与したとき、未変化体に対する M6 の AUC の幾何平均値の比は、1 日目の AUCtau が 0.00397、
5 日目の AUCtau が 0.00866、5 日目の AUCinf が 0.0448 であった。本薬単回経口投与時の血漿中の主な代
謝物は M6 であった(6.2.1.1 参照)ことから、本薬の血漿曝露に対して 10%を超える曝露を示す代謝物
はないと考える、と申請者は説明している。
6.2.2
薬物相互作用の検討(CTD 5.3.3.1-01:T1211 試験<2021 年 7 月~継続中(2022 年 2 月データカ
ットオフ)>コホート G、L、M)
本薬が併用薬の PK に及ぼす影響が検討され、本薬非併用時に対する併用時の併用薬の血漿中 PK パ
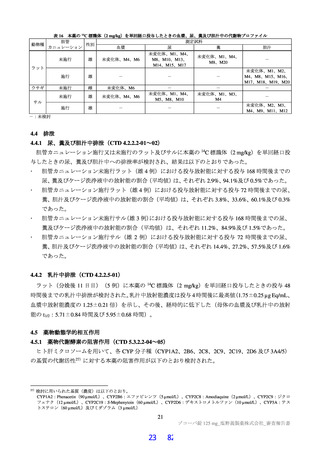
ラメータの最小二乗幾何平均値の比(併用時/非併用時)[90%信頼区間]は、表 26 のとおりであった。
表 26
本薬の用法・用量
併用薬の PK パラメータに及ぼす本薬の影響
最小二乗幾何平均値の比[90%信頼区間]
併用薬
(併用時/非併用時)
例数 a)
Cmax
AUCinf
用法・用量
投与日
750/250 mg b)
(懸濁剤)
薬剤名
ミダゾラム
(経口)
750/250 mg d)
(錠剤)
デキサメタゾン
(経口)
1 mg 単回
750/250 mg d)
(錠剤)
プレドニゾロン
(経口)
10 mg 単回
2 mg 単回
6 日目
7 c)/8
2.78[2.33, 3.30]
8.80[6.71, 11.5]
5 日目
9 日目
14 日目
5 日目
9 日目
14 日目
14 e)/14 f)
14/14f)
14 e)/14 f)
14/14
14/14
14/14
1.47[1.30, 1.67]
1.24[1.09, 1.40]
1.17[1.04, 1.33]
1.11[1.00, 1.24]
1.10[0.99, 1.22]
0.99[0.89, 1.10]
3.47[3.23, 3.72]
2.38[2.23, 2.54]
1.58[1.47, 1.70]
1.25[1.22, 1.28]
1.12[1.10, 1.15]
1.04[1.01, 1.07]
a)併用時の例数/非併用時の例数
b)1 日目は本薬 750 mg を 1 日 1 回、2 日目から 6 日目は本薬 250 mg を 1 日 1 回経口投与
c)AUCinf は 5 例
d)1 日目は本薬 750 mg を 1 日 1 回、2 日目から 5 日目は本薬 250 mg を 1 日 1 回経口投与
e)AUCinf は 11 例
f)AUCinf は 13 例
6.2.3
血漿中薬物濃度-反応解析による QT/QTc 間隔延長リスクの評価(CTD 5.3.4.1-01)
国内第Ⅰ相試験(T1211 試験)において、日本人健康成人に本薬 20、70、250、500、1000 又は 2000 mg
を単回経口投与したときの本薬の血漿中濃度(6.2.1.1 参照)及び心電図データに基づき、線形混合効果
モデルを用いて、本薬の血漿中濃度と Fridericia 式による補正 QTc 間隔のベースラインからの変化量(以
下、「ΔQTcF」)の関係が検討された。
本薬 2,000 mg 単回投与時とプラセボ投与時の ΔQTcF の差(以下、「ΔΔQTcF」)の最小二乗平均[90%
信頼区間]は、1.79[-1.97, 5.54]ms と予測され、90%信頼区間の上限は 10 ms を下回った。また、検
討された血漿中濃度[Cmax(幾何平均値)1.70~96.9 μg/mL]の範囲において、ΔΔQTcF は 0 ms 付近であ
り、QT/QTc 間隔延長リスクは示されなかった。
6.2.4
6.2.4.1
薬物動態解析
PPK 解析(CTD 5.3.3.5-01)
本薬の懸濁剤及び錠剤を用いた臨床試験 2 試験[国内第Ⅰ相試験(T1211 試験)及び国際共同第Ⅱ/Ⅲ
相試験(T1221 試験)の第Ⅱa 相パート及び第Ⅱb 相パート]の 443 例[性別(男性:283 例、女性:160
例)、製剤(懸濁剤:78 例、錠剤:365 例)、健康状態(健康被験者:120 例、SARS-CoV-2 感染者:323
36
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
38 / 82
回経口投与したとき、未変化体に対する M6 の AUC の幾何平均値の比は、1 日目の AUCtau が 0.00397、
5 日目の AUCtau が 0.00866、5 日目の AUCinf が 0.0448 であった。本薬単回経口投与時の血漿中の主な代
謝物は M6 であった(6.2.1.1 参照)ことから、本薬の血漿曝露に対して 10%を超える曝露を示す代謝物
はないと考える、と申請者は説明している。
6.2.2
薬物相互作用の検討(CTD 5.3.3.1-01:T1211 試験<2021 年 7 月~継続中(2022 年 2 月データカ
ットオフ)>コホート G、L、M)
本薬が併用薬の PK に及ぼす影響が検討され、本薬非併用時に対する併用時の併用薬の血漿中 PK パ
ラメータの最小二乗幾何平均値の比(併用時/非併用時)[90%信頼区間]は、表 26 のとおりであった。
表 26
本薬の用法・用量
併用薬の PK パラメータに及ぼす本薬の影響
最小二乗幾何平均値の比[90%信頼区間]
併用薬
(併用時/非併用時)
例数 a)
Cmax
AUCinf
用法・用量
投与日
750/250 mg b)
(懸濁剤)
薬剤名
ミダゾラム
(経口)
750/250 mg d)
(錠剤)
デキサメタゾン
(経口)
1 mg 単回
750/250 mg d)
(錠剤)
プレドニゾロン
(経口)
10 mg 単回
2 mg 単回
6 日目
7 c)/8
2.78[2.33, 3.30]
8.80[6.71, 11.5]
5 日目
9 日目
14 日目
5 日目
9 日目
14 日目
14 e)/14 f)
14/14f)
14 e)/14 f)
14/14
14/14
14/14
1.47[1.30, 1.67]
1.24[1.09, 1.40]
1.17[1.04, 1.33]
1.11[1.00, 1.24]
1.10[0.99, 1.22]
0.99[0.89, 1.10]
3.47[3.23, 3.72]
2.38[2.23, 2.54]
1.58[1.47, 1.70]
1.25[1.22, 1.28]
1.12[1.10, 1.15]
1.04[1.01, 1.07]
a)併用時の例数/非併用時の例数
b)1 日目は本薬 750 mg を 1 日 1 回、2 日目から 6 日目は本薬 250 mg を 1 日 1 回経口投与
c)AUCinf は 5 例
d)1 日目は本薬 750 mg を 1 日 1 回、2 日目から 5 日目は本薬 250 mg を 1 日 1 回経口投与
e)AUCinf は 11 例
f)AUCinf は 13 例
6.2.3
血漿中薬物濃度-反応解析による QT/QTc 間隔延長リスクの評価(CTD 5.3.4.1-01)
国内第Ⅰ相試験(T1211 試験)において、日本人健康成人に本薬 20、70、250、500、1000 又は 2000 mg
を単回経口投与したときの本薬の血漿中濃度(6.2.1.1 参照)及び心電図データに基づき、線形混合効果
モデルを用いて、本薬の血漿中濃度と Fridericia 式による補正 QTc 間隔のベースラインからの変化量(以
下、「ΔQTcF」)の関係が検討された。
本薬 2,000 mg 単回投与時とプラセボ投与時の ΔQTcF の差(以下、「ΔΔQTcF」)の最小二乗平均[90%
信頼区間]は、1.79[-1.97, 5.54]ms と予測され、90%信頼区間の上限は 10 ms を下回った。また、検
討された血漿中濃度[Cmax(幾何平均値)1.70~96.9 μg/mL]の範囲において、ΔΔQTcF は 0 ms 付近であ
り、QT/QTc 間隔延長リスクは示されなかった。
6.2.4
6.2.4.1
薬物動態解析
PPK 解析(CTD 5.3.3.5-01)
本薬の懸濁剤及び錠剤を用いた臨床試験 2 試験[国内第Ⅰ相試験(T1211 試験)及び国際共同第Ⅱ/Ⅲ
相試験(T1221 試験)の第Ⅱa 相パート及び第Ⅱb 相パート]の 443 例[性別(男性:283 例、女性:160
例)、製剤(懸濁剤:78 例、錠剤:365 例)、健康状態(健康被験者:120 例、SARS-CoV-2 感染者:323
36
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
38 / 82