よむ、つかう、まなぶ。
【資料No.1】★審査報告書 (50 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
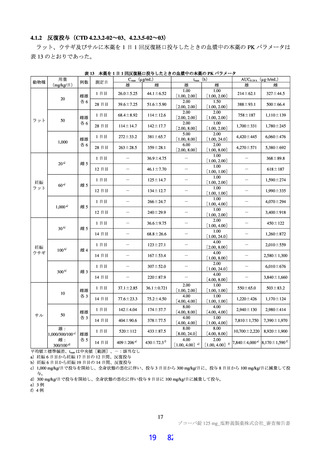
ン、メトホルミン)の血漿中 PK パラメータの最小二乗幾何平均値の比[90%信頼区間]は表 29 のとお
りであった。ジゴキシン及びロスバスタチンにおいては、本薬併用時に曝露量の上昇が認められたこと
から、併用薬の安全域及び発現する可能性のある副作用の重篤性も考慮して、P-gp の基質薬であるジゴ
キシン及びダビガトランエテキシラートメタンスルホン酸塩、並びに BCRP、OATP1B1 及び OATP1B3
の基質薬であるロスバスタチンカルシウムとの併用は併用注意とし、これらの薬剤の血漿中濃度を上昇
させるおそれがある旨を、添付文書において注意喚起する。
表 29
併用薬の PK パラメータに及ぼす本薬の影響
最小二乗幾何平均値の比[90%信頼区間]
併用薬
(併用時/非併用時)
例数 a)
Cmax
AUCinf
用法・用量 a)
本薬の
用法・用量
薬剤名
ジゴキシン(経口)
500 mg 単回 b)
ロスバスタチン(経口)
メトホルミン(経口)
a)併用時の例数/非併用時の例数
b)錠剤
c)AUCinf は 11 例
d)AUCinf は 13 例
0.25 mg 単回
2.5 mg 単回
500 mg 単回
14 c)/14 d)
14/14
14/14
2.17[1.72, 2.73]
1.97[1.73, 2.25]
1.03[0.91, 1.16]
1.31[1.13, 1.52]
1.65[1.47, 1.84]
1.02[0.94, 1.11]
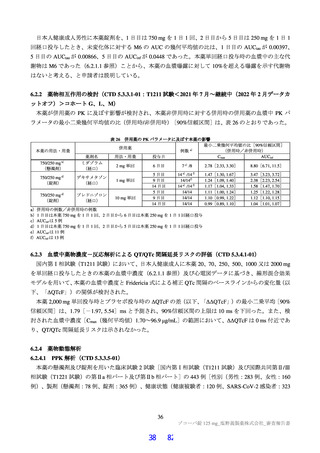
本薬と OAT3 の基質薬の臨床薬物相互作用試験は実施しておらず、本薬との併用により OAT3 の基質
薬の血漿中濃度を上昇させる可能性は否定できないことから、安全域の狭い OAT3 の基質薬であるメト
トレキサートとの併用は併用注意とし、血漿中濃度を上昇されるおそれがある旨を、添付文書において
注意喚起する。
機構は、以下のように考える。
申請者の説明は受入れ可能と考える。ただし、本薬が OAT3 の基質薬の血漿中濃度に与える影響の程
度については情報が得られていないことから、本薬と OAT3 の基質薬の併用に関する情報は、公表文献
等も含め引き続き収集を行う必要があると考える。
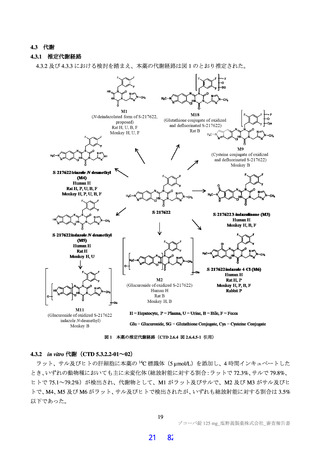
臨床的有効性及び臨床的安全性に関する資料並びに機構における審査の概略
7.
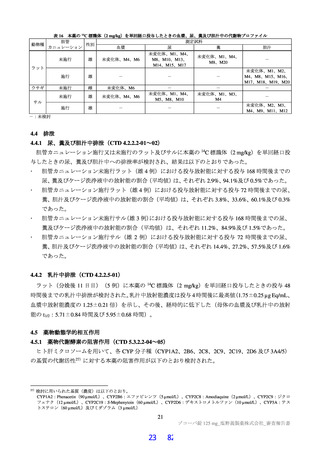
本申請に際し、有効性及び安全性に関する主な資料として、表 30 に示す臨床試験成績が提出された。
表 30
資料 実施
試験名
区分 地域
相
<第Ⅱa 相パート>
無症状の SARS-CoV-2 病原体保
有者及び SARS-CoV-2 による感
染症患者
登録例数
用法・用量の概略
主な
評価項目
<第Ⅱa 相パート>
<全パート>
①22 例
①1 日目は本薬 375 mg を 1 日 1 回、2 日目
②23 例
~5 日目は本薬 125 mg を 1 日 1 回経口投与
③24 例
有効性
②1 日目は本薬 750 mg を 1 日 1 回、2 日目 安全性
<第Ⅱb 相パート>
~5 日目は本薬 250 mg を 1 日 1 回経口投与
<第Ⅱb 相パート>
①142 例
SARS-CoV-2 による感染症患者
②143 例
③プラセボを 1 日 1 回 5 日間経口投与
③143 例
a)本試験には第Ⅲ相パート及び第Ⅱb/Ⅲ相パートが含まれるが、これらのパートの結果は提出されていない。
評価
国際
T1221 Ⅱ/Ⅲa)
共同
対象患者
主な臨床試験の概要
48
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
50 / 82
りであった。ジゴキシン及びロスバスタチンにおいては、本薬併用時に曝露量の上昇が認められたこと
から、併用薬の安全域及び発現する可能性のある副作用の重篤性も考慮して、P-gp の基質薬であるジゴ
キシン及びダビガトランエテキシラートメタンスルホン酸塩、並びに BCRP、OATP1B1 及び OATP1B3
の基質薬であるロスバスタチンカルシウムとの併用は併用注意とし、これらの薬剤の血漿中濃度を上昇
させるおそれがある旨を、添付文書において注意喚起する。
表 29
併用薬の PK パラメータに及ぼす本薬の影響
最小二乗幾何平均値の比[90%信頼区間]
併用薬
(併用時/非併用時)
例数 a)
Cmax
AUCinf
用法・用量 a)
本薬の
用法・用量
薬剤名
ジゴキシン(経口)
500 mg 単回 b)
ロスバスタチン(経口)
メトホルミン(経口)
a)併用時の例数/非併用時の例数
b)錠剤
c)AUCinf は 11 例
d)AUCinf は 13 例
0.25 mg 単回
2.5 mg 単回
500 mg 単回
14 c)/14 d)
14/14
14/14
2.17[1.72, 2.73]
1.97[1.73, 2.25]
1.03[0.91, 1.16]
1.31[1.13, 1.52]
1.65[1.47, 1.84]
1.02[0.94, 1.11]
本薬と OAT3 の基質薬の臨床薬物相互作用試験は実施しておらず、本薬との併用により OAT3 の基質
薬の血漿中濃度を上昇させる可能性は否定できないことから、安全域の狭い OAT3 の基質薬であるメト
トレキサートとの併用は併用注意とし、血漿中濃度を上昇されるおそれがある旨を、添付文書において
注意喚起する。
機構は、以下のように考える。
申請者の説明は受入れ可能と考える。ただし、本薬が OAT3 の基質薬の血漿中濃度に与える影響の程
度については情報が得られていないことから、本薬と OAT3 の基質薬の併用に関する情報は、公表文献
等も含め引き続き収集を行う必要があると考える。
臨床的有効性及び臨床的安全性に関する資料並びに機構における審査の概略
7.
本申請に際し、有効性及び安全性に関する主な資料として、表 30 に示す臨床試験成績が提出された。
表 30
資料 実施
試験名
区分 地域
相
<第Ⅱa 相パート>
無症状の SARS-CoV-2 病原体保
有者及び SARS-CoV-2 による感
染症患者
登録例数
用法・用量の概略
主な
評価項目
<第Ⅱa 相パート>
<全パート>
①22 例
①1 日目は本薬 375 mg を 1 日 1 回、2 日目
②23 例
~5 日目は本薬 125 mg を 1 日 1 回経口投与
③24 例
有効性
②1 日目は本薬 750 mg を 1 日 1 回、2 日目 安全性
<第Ⅱb 相パート>
~5 日目は本薬 250 mg を 1 日 1 回経口投与
<第Ⅱb 相パート>
①142 例
SARS-CoV-2 による感染症患者
②143 例
③プラセボを 1 日 1 回 5 日間経口投与
③143 例
a)本試験には第Ⅲ相パート及び第Ⅱb/Ⅲ相パートが含まれるが、これらのパートの結果は提出されていない。
評価
国際
T1221 Ⅱ/Ⅲa)
共同
対象患者
主な臨床試験の概要
48
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
50 / 82