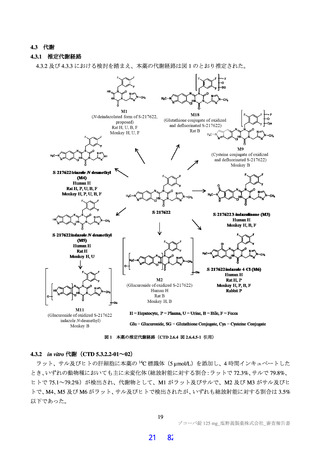
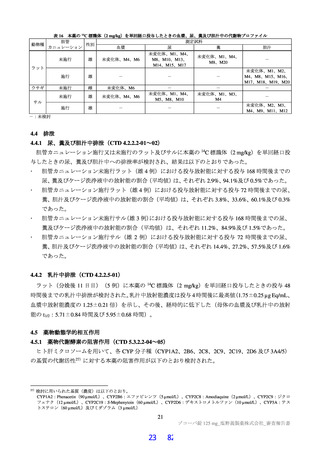
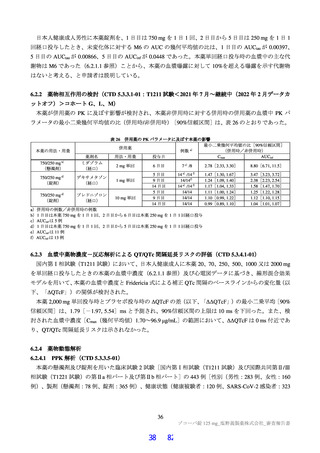
よむ、つかう、まなぶ。
【資料No.1】★審査報告書 (62 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
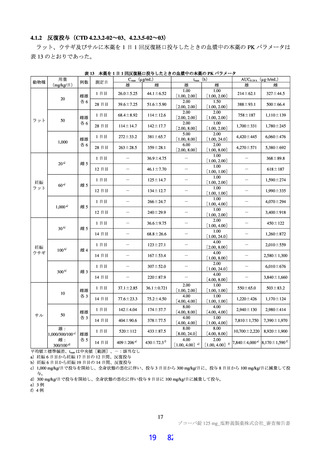
国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅱb 相パートの副次評価項目の一つである、SARS-CoV-2 に
よる感染症の 12 症状の分類別62)スコアの治験薬投与開始(Day 1)から 120 時間(Day 6)までの単位時
間当たりの変化量のうち、omicron 株に特徴的な呼吸器症状[鼻水又は鼻づまり、喉の痛み、咳、息切れ
(呼吸困難)]の結果は表 38 のとおりであり、仮説検定の多重性は調整されていないものの、プラセボ
群と比較して、本薬 375/125 mg 群及び本薬 750/250 mg 群のいずれにおいても統計学的に有意な差が認
められた(それぞれ両側 p 値は p=0.0153、p=0.0033)。
表 38
呼吸器症状の治験薬投与開始(Day 1)から 120 時間(Day 6)までの単位時間当たりの変化量(第Ⅱb 相パート:ITT1 集団)
本薬 375/125 mg 群
本薬 750/250 mg 群
プラセボ群
(114 例)
(116 例)
(111 例)
呼吸器症状[鼻水又は鼻づまり、喉の痛み、咳、息
-2.28±1.54
-2.33±1.58
-1.67±1.44
切れ(呼吸困難)]の治験薬投与開始(Day 1)から
(106 例)b)
(111 例)b)
(109 例)b)
120 時間(Day 6)までの単位時間当たりの変化量
プラセボ群との群間差[95%信頼区間]a)
-0.37[-0.67, -0.07]
-0.44[-0.74, -0.15]
-
平均値±標準偏差
a)ベースラインの 12 症状合計スコア、SARS-CoV-2 による感染症の症状発現からランダム化までの時間(72 時間未満、72 時間以上)、
SARS-CoV-2 による感染症に対するワクチン接種歴の有無を共変量とした ANCOVA モデル
b)ベースライン又は投与開始後のスコアが得られなかった被験者は解析から除外された。
また、omicron 株に特徴的な症状に対する臨床症状改善効果を確認するために、事後解析として、SARSCoV-2 による感染症の 12 症状のうち、ベースラインにおけるスコアの平均値が 1 以上であった症状(鼻
水又は鼻づまり、喉の痛み、咳、熱っぽさ又は発熱)に、SARS-CoV-2 による感染症の重症度分類の指
標の一つである息切れ(呼吸困難)を加えた 5 症状について、治験薬投与開始(Day 1)から 120 時間
(Day 6)までの単位時間当たりの変化量(平均値±標準偏差)を確認したところ、本薬 375/125 mg 群
で-3.17±1.79、本薬 750/250 mg 群で-3.26±1.81、プラセボ群で-2.49±1.66 であり、本薬 375/125 mg
群とプラセボ群、本薬 750/250 mg 群とプラセボ群の群間差の最小二乗平均値[95%信頼区間]はそれぞ
れ-0.40[-0.73, -0.07]、-0.48[-0.80, -0.15]であり、仮説検定の多重性は調整されていないも
ののプラセボ群と比較していずれの本薬群においても統計学的に有意な差が認められた(それぞれ両側
p 値は p=0.0164、p=0.0039)。
加えて、第Ⅱa 相パート及び第Ⅱb 相パートのいずれにおいても、Day 4 のウイルス RNA 量(RT-PCR)
のベースラインからの変化量の平均値が、プラセボ群と比較して本薬群において約 1 log10(copies/mL)
減少する傾向が認められた。
以上を総合的に勘案すると、本剤の SARS-CoV-2 に対する抗ウイルス効果及び臨床症状改善効果が確
認されたと考える。
機構は、国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅱa 相パート及び第Ⅱb 相パートの成績について、
以下のように考える。
62)
第Ⅱb 相パートにおいて事前に規定した本試験の有効性の主要評価項目について、成功基準は満た
以下の分類が用いられた。
・
急性症状:喉の痛み、咳、熱っぽさ又は発熱
・
主な臨床症状:鼻水又は鼻づまり、喉の痛み、咳、悪寒又は発汗、熱っぽさ又は発熱
・
呼吸器症状:鼻水又は鼻づまり、喉の痛み、咳、息切れ(呼吸困難)
・
全身症状:倦怠感(疲労感)、筋肉痛又は体の痛み、頭痛、悪寒又は発汗、熱っぽさ又は発熱
・
消化器症状:吐き気、嘔吐、下痢
60
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
62 / 82
よる感染症の 12 症状の分類別62)スコアの治験薬投与開始(Day 1)から 120 時間(Day 6)までの単位時
間当たりの変化量のうち、omicron 株に特徴的な呼吸器症状[鼻水又は鼻づまり、喉の痛み、咳、息切れ
(呼吸困難)]の結果は表 38 のとおりであり、仮説検定の多重性は調整されていないものの、プラセボ
群と比較して、本薬 375/125 mg 群及び本薬 750/250 mg 群のいずれにおいても統計学的に有意な差が認
められた(それぞれ両側 p 値は p=0.0153、p=0.0033)。
表 38
呼吸器症状の治験薬投与開始(Day 1)から 120 時間(Day 6)までの単位時間当たりの変化量(第Ⅱb 相パート:ITT1 集団)
本薬 375/125 mg 群
本薬 750/250 mg 群
プラセボ群
(114 例)
(116 例)
(111 例)
呼吸器症状[鼻水又は鼻づまり、喉の痛み、咳、息
-2.28±1.54
-2.33±1.58
-1.67±1.44
切れ(呼吸困難)]の治験薬投与開始(Day 1)から
(106 例)b)
(111 例)b)
(109 例)b)
120 時間(Day 6)までの単位時間当たりの変化量
プラセボ群との群間差[95%信頼区間]a)
-0.37[-0.67, -0.07]
-0.44[-0.74, -0.15]
-
平均値±標準偏差
a)ベースラインの 12 症状合計スコア、SARS-CoV-2 による感染症の症状発現からランダム化までの時間(72 時間未満、72 時間以上)、
SARS-CoV-2 による感染症に対するワクチン接種歴の有無を共変量とした ANCOVA モデル
b)ベースライン又は投与開始後のスコアが得られなかった被験者は解析から除外された。
また、omicron 株に特徴的な症状に対する臨床症状改善効果を確認するために、事後解析として、SARSCoV-2 による感染症の 12 症状のうち、ベースラインにおけるスコアの平均値が 1 以上であった症状(鼻
水又は鼻づまり、喉の痛み、咳、熱っぽさ又は発熱)に、SARS-CoV-2 による感染症の重症度分類の指
標の一つである息切れ(呼吸困難)を加えた 5 症状について、治験薬投与開始(Day 1)から 120 時間
(Day 6)までの単位時間当たりの変化量(平均値±標準偏差)を確認したところ、本薬 375/125 mg 群
で-3.17±1.79、本薬 750/250 mg 群で-3.26±1.81、プラセボ群で-2.49±1.66 であり、本薬 375/125 mg
群とプラセボ群、本薬 750/250 mg 群とプラセボ群の群間差の最小二乗平均値[95%信頼区間]はそれぞ
れ-0.40[-0.73, -0.07]、-0.48[-0.80, -0.15]であり、仮説検定の多重性は調整されていないも
ののプラセボ群と比較していずれの本薬群においても統計学的に有意な差が認められた(それぞれ両側
p 値は p=0.0164、p=0.0039)。
加えて、第Ⅱa 相パート及び第Ⅱb 相パートのいずれにおいても、Day 4 のウイルス RNA 量(RT-PCR)
のベースラインからの変化量の平均値が、プラセボ群と比較して本薬群において約 1 log10(copies/mL)
減少する傾向が認められた。
以上を総合的に勘案すると、本剤の SARS-CoV-2 に対する抗ウイルス効果及び臨床症状改善効果が確
認されたと考える。
機構は、国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅱa 相パート及び第Ⅱb 相パートの成績について、
以下のように考える。
62)
第Ⅱb 相パートにおいて事前に規定した本試験の有効性の主要評価項目について、成功基準は満た
以下の分類が用いられた。
・
急性症状:喉の痛み、咳、熱っぽさ又は発熱
・
主な臨床症状:鼻水又は鼻づまり、喉の痛み、咳、悪寒又は発汗、熱っぽさ又は発熱
・
呼吸器症状:鼻水又は鼻づまり、喉の痛み、咳、息切れ(呼吸困難)
・
全身症状:倦怠感(疲労感)、筋肉痛又は体の痛み、頭痛、悪寒又は発汗、熱っぽさ又は発熱
・
消化器症状:吐き気、嘔吐、下痢
60
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
62 / 82