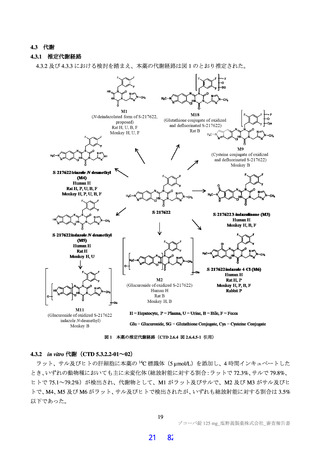
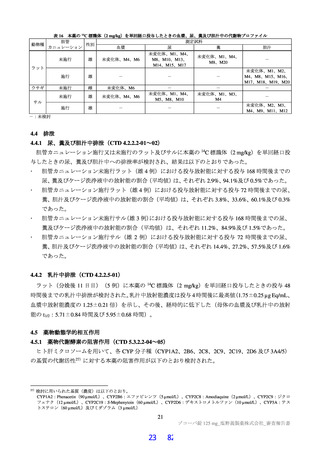
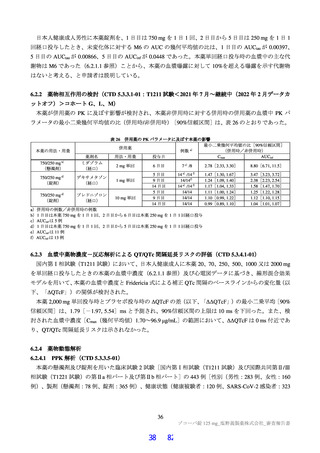
よむ、つかう、まなぶ。
【資料No.1】★審査報告書 (60 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
7.R 機構における審査の概略
7.R.1
国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の試験計画について
申請者は、本剤の有効性及び安全性に係る主な臨床試験として実施中の国際共同第Ⅱ/Ⅲ相試験(T1221
試験)について、以下のように説明している。
本試験は、表 37 のとおり、4 つのパートから構成され、第Ⅲ相パート及び第Ⅱb/Ⅲ相パートは実施中
であり、本申請に際し、第Ⅱa 相パート及び第Ⅱb 相パートの成績に基づき、本剤の有効性及び安全性に
ついて検討を行った。
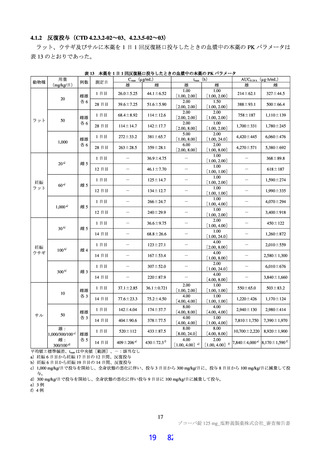
表 37
パート
第Ⅱa 相パート
第Ⅱb 相パート
第Ⅲ相パート
第Ⅱb/Ⅲ相パート
国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の構成
主目的
軽症~中等症の SARS-CoV-2 による感染症患者及び無症状の SARS-CoV-2 病原体保有者を対象として本薬
の抗ウイルス活性を確認すること
軽症~中等症の SARS-CoV-2 による感染症患者を対象として本薬の臨床症状の改善及び抗ウイルス活性を
確認すること
軽症~中等症の SARS-CoV-2 による感染症患者を対象として本薬の有効性を検証すること
無症状の SARS-CoV-2 病原体保有者及び軽度の症状のみを有する SARS-CoV-2 による感染症患者を対象と
して本薬の有効性を検証すること
なお、国際共同第Ⅱ/Ⅲ相試験(T1221 試験)のプロトコル第 6 版(2021 年 12 月 28 日作成)までは軽
症~中等症の SARS-CoV-2 による感染症患者を対象とした第Ⅱb/Ⅲ相パート(以降、旧第Ⅱb/Ⅲ相パー
ト)が計画されていたが、旧第Ⅱb/Ⅲ相パートの実施中にプロトコル第 7 版(2022 年 2 月 7 日作成)へ
改訂し、新たに第Ⅱb 相パートを設け、旧第Ⅱb/Ⅲ相パートは第Ⅲ相パートと変更した。
国内外で SARS-CoV-2 による感染症の疾患定義、診断方法及び治療法に大きな違いはなく、軽症~中
等症の患者には抗ウイルス薬や中和抗体が重症化リスク因子を有する患者を中心に使用されていること、
日本人と外国人の間で本薬の PK に明らかな差異は認められなかったこと(6.2.1.2 参照)、非臨床試験
において SARS-CoV-2 の複数の株に対する本薬の抗ウイルス活性が示されており、流行株の影響は小さ
いと考えたこと(3.1.2.1 参照)等から本剤の評価に及ぼす内因性及び外因性の民族的要因の影響は低い
と考え、本試験を国際共同試験として実施した。
第Ⅱb 相パートの主要評価項目は、第Ⅱa 相パートの結果も参考に、以下の点を踏まえ「SARS-CoV-2
による感染症の 12 症状合計スコアの治験薬投与開始(Day 1)から 120 時間(Day 6)までの単位時間当
たりの変化量及び Day 4 における SARS-CoV-2 のウイルス力価のベースラインからの変化量」の coprimary endpoint と設定した。
・
臨床症状の評価項目について、治験薬投与終了翌日の Day 6 時点におけるベースラインからの変
化量で評価した場合、Day 6 以前の治療効果を表す変化量の情報を間接的にしか考慮できないこ
と、他の SARS-CoV-2 による感染症の治療薬において症状合計スコアの変化量の AUC を副次評
価項目にしていること59)、各症状の累積が患者にとっての臨床上の負担であり、その負担を軽減
することに臨床的意義があると考えたこと、12 症状合計スコアが早期に低下することが症状回復
までの時間を短縮することに寄与すると考えたことから、12 症状合計スコアの各時点のベースラ
59)
JAMA 2022; 327: 1236-46
58
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
60 / 82
7.R.1
国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の試験計画について
申請者は、本剤の有効性及び安全性に係る主な臨床試験として実施中の国際共同第Ⅱ/Ⅲ相試験(T1221
試験)について、以下のように説明している。
本試験は、表 37 のとおり、4 つのパートから構成され、第Ⅲ相パート及び第Ⅱb/Ⅲ相パートは実施中
であり、本申請に際し、第Ⅱa 相パート及び第Ⅱb 相パートの成績に基づき、本剤の有効性及び安全性に
ついて検討を行った。
表 37
パート
第Ⅱa 相パート
第Ⅱb 相パート
第Ⅲ相パート
第Ⅱb/Ⅲ相パート
国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の構成
主目的
軽症~中等症の SARS-CoV-2 による感染症患者及び無症状の SARS-CoV-2 病原体保有者を対象として本薬
の抗ウイルス活性を確認すること
軽症~中等症の SARS-CoV-2 による感染症患者を対象として本薬の臨床症状の改善及び抗ウイルス活性を
確認すること
軽症~中等症の SARS-CoV-2 による感染症患者を対象として本薬の有効性を検証すること
無症状の SARS-CoV-2 病原体保有者及び軽度の症状のみを有する SARS-CoV-2 による感染症患者を対象と
して本薬の有効性を検証すること
なお、国際共同第Ⅱ/Ⅲ相試験(T1221 試験)のプロトコル第 6 版(2021 年 12 月 28 日作成)までは軽
症~中等症の SARS-CoV-2 による感染症患者を対象とした第Ⅱb/Ⅲ相パート(以降、旧第Ⅱb/Ⅲ相パー
ト)が計画されていたが、旧第Ⅱb/Ⅲ相パートの実施中にプロトコル第 7 版(2022 年 2 月 7 日作成)へ
改訂し、新たに第Ⅱb 相パートを設け、旧第Ⅱb/Ⅲ相パートは第Ⅲ相パートと変更した。
国内外で SARS-CoV-2 による感染症の疾患定義、診断方法及び治療法に大きな違いはなく、軽症~中
等症の患者には抗ウイルス薬や中和抗体が重症化リスク因子を有する患者を中心に使用されていること、
日本人と外国人の間で本薬の PK に明らかな差異は認められなかったこと(6.2.1.2 参照)、非臨床試験
において SARS-CoV-2 の複数の株に対する本薬の抗ウイルス活性が示されており、流行株の影響は小さ
いと考えたこと(3.1.2.1 参照)等から本剤の評価に及ぼす内因性及び外因性の民族的要因の影響は低い
と考え、本試験を国際共同試験として実施した。
第Ⅱb 相パートの主要評価項目は、第Ⅱa 相パートの結果も参考に、以下の点を踏まえ「SARS-CoV-2
による感染症の 12 症状合計スコアの治験薬投与開始(Day 1)から 120 時間(Day 6)までの単位時間当
たりの変化量及び Day 4 における SARS-CoV-2 のウイルス力価のベースラインからの変化量」の coprimary endpoint と設定した。
・
臨床症状の評価項目について、治験薬投与終了翌日の Day 6 時点におけるベースラインからの変
化量で評価した場合、Day 6 以前の治療効果を表す変化量の情報を間接的にしか考慮できないこ
と、他の SARS-CoV-2 による感染症の治療薬において症状合計スコアの変化量の AUC を副次評
価項目にしていること59)、各症状の累積が患者にとっての臨床上の負担であり、その負担を軽減
することに臨床的意義があると考えたこと、12 症状合計スコアが早期に低下することが症状回復
までの時間を短縮することに寄与すると考えたことから、12 症状合計スコアの各時点のベースラ
59)
JAMA 2022; 327: 1236-46
58
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
60 / 82