よむ、つかう、まなぶ。
【資料No.1】★審査報告書 (49 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
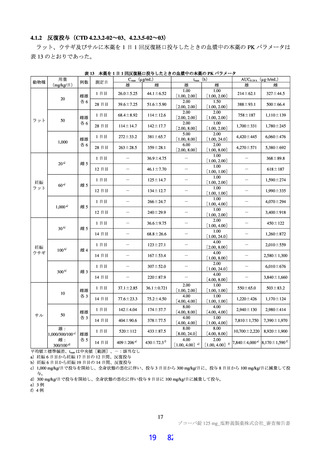
表 28 本薬と CYP3A の基質薬との薬物相互作用の検討に用いられた PBPK モデル解析における主な懸念点
本薬についてはヒトでのマスバランス試験の結果が得られておらず、ヒトにおける本薬の経口吸収率や本薬の消失に対する代
謝の寄与率等の情報が限定的であること。
本薬とミダゾラムの臨床薬物相互作用試験における本薬の剤形は懸濁剤であるが、市販予定製剤は錠剤であることから、当該
PBPK モデルでは剤形の違いを考慮して、本薬の fa を、本薬懸濁剤及び本薬錠剤投与時の成績(6.2.1.2 参照)から、懸濁剤は
1、錠剤は 0.7 と設定している一方で、PPK 解析の最終モデル(6.2.4.1 参照)では本薬の fa に対する剤形の影響を考慮する必要
がないと判断されていること。
本薬の消失に対する CYP3A4 の寄与率について、反復投与時の蓄積率から推定した値(6.R.6.1 参照)が用いられており、強力
な CYP3A 阻害薬との臨床薬物相互作用試験は実施されておらず、本薬の消失に対する CYP3A4 の寄与率を検討するためのデ
ータは限定的である。また、PPK 解析においては、時間依存的阻害作用を考慮しないモデルが最終モデルとされ、時間依存的
阻害作用を考慮しないモデルでも本薬の反復投与後の血漿中濃度推移は記述可能であったとの説明もされており、当該設定値
については不確実性が伴うと考えること。
CYP3A4/5 に対する本薬の KI 及び kinact は、in vitro 試験(4.5.1 参照)の成績に基づき設定されている。一方で、本薬は in vitro 試
験において CYP3A4 に対する誘導作用も認められている(4.5.2 参照)ものの、本薬の CYP3A4/5 に対する誘導作用について、
当該 PBPK モデルでは考慮されていないこと。
本薬と CYP3A 基質薬併用投与時の PBPK モデルの検証について、本薬の申請用法・用量(375/125 mg)よりも高用量(750/250 mg)
で投与したときの臨床薬物相互作用試験成績に基づき行われており、本薬を申請用法・用量で投与したときの血漿中本薬曝露
域における本薬の CYP3A 阻害作用に係るモデルの検証は十分に行われていないこと。
本薬 750/250 mg 投与時の検討ではあるが、感度分析としてミクロソーム中の遊離型薬物分率(fu,mic)49)を 0.4~1.0 に変動させ
た場合のミダゾラムの AUCinf の予測上昇率は 5.12~10.5 倍と大きく変動すること。
本薬 750/250 mg を併用投与した場合のミダゾラム又はデキサメタゾンの血漿中濃度推移の予測において、ミダゾラム及びデキ
サメタゾンの血漿中濃度推移の実測値と予測値が一致していない傾向が認められており50)、当該不一致が本薬錠剤を申請用法・
用量(375/125 mg)で併用投与した場合のミダゾラムの PK の推定結果に与える影響も十分に検討されていないこと。
本薬の fu,gut は 0.000001 と設定されたが、当該パラメータの適切性については十分に説明されておらず、当該パラメータが他の
パラメータの設定や本薬錠剤を申請用法・用量(375/125 mg)で併用投与した場合のミダゾラムの PK の推定結果に与える影響
が検討されていないこと。
申請者は、以下のように説明した。
機構の意見を踏まえ、本薬を申請用法・用量で投与した場合のミダゾラムとの臨床薬物相互作用試験
を新たに実施する。本薬と CYP3A の基質薬との併用に係る注意喚起については、現時点では、併用時
に想定される最大のリスクを勘案し、750/250 mg とミダゾラムの臨床薬物相互作用試験におけるミダゾ
ラムの AUCinf の上昇率(8.80 倍、6.2.2 参照)及び他の強い CYP3A 阻害薬の添付文書も参考に併用禁忌
及び併用注意を設定し、当該試験結果が得られた後に再検討することとしたい。
機構は、申請者の説明を了承した。
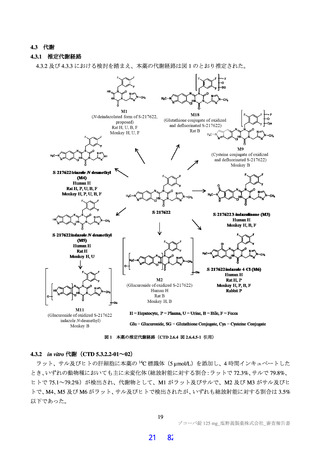
6.R.6.2.2
本薬と P-gp、BCRP、OATP1B1、OATP1B3、OCT1 及び OAT3 の基質薬との併用について
申請者は、in vitro の検討において、本薬の P-gp、BCRP、OATP1B1、OATP1B3、OCT1 及び OAT3 阻
害作用が、「『医薬品開発と適正な情報提供のための薬物相互作用ガイドライン』について」(平成 30
年 7 月 23 日付け 薬生薬審発 0723 第 4 号)で規定されている臨床薬物相互作用試験の実施が考慮され
るカットオフ基準を超えたことを踏まえ、本薬と当該トランスポーターの基質薬との薬物相互作用につ
いて、以下のように説明している。
本薬と P-gp、BCRP、OATP1B1、OATP1B3 及び OCT1 の基質薬との薬物相互作用を検討するため、カ
クテル基質を用いた臨床薬物相互作用試験(T1215 試験)を実施した。総括報告書は未完成であるが、
PK 解析結果が得られており、本薬非併用時に対する本薬併用時の併用薬(ジゴキシン、ロスバスタチ
fu,mic は本薬 750/250 mg 投与とミダゾラムとの併用時におけるミダゾラムの AUCinf の上昇率(8.80 倍、6.2.2 参照)の成績に基づき、
0.5 と推定されている。
50)
当該不一致が生じた理由について、申請者は、臨床薬物相互作用試験(6.2.2 参照)で使用されたミダゾラム及びデキサメタゾンの製
剤[ミダゾラム:シロップ剤、デキサメタゾン:錠剤(国内市販製剤)]と、ミダゾラム及びデキサメタゾンの PBPK モデルの構築
に使用された製剤[ミダゾラム:錠剤(Clin Pharmacol Ther 1981; 30: 653-61)、デキサメタゾン:錠剤(海外市販製剤)(Eur Clin Respir
J 2017;4:1353395)]が異なるためと説明している。
49)
47
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
49 / 82
表 28 本薬と CYP3A の基質薬との薬物相互作用の検討に用いられた PBPK モデル解析における主な懸念点
本薬についてはヒトでのマスバランス試験の結果が得られておらず、ヒトにおける本薬の経口吸収率や本薬の消失に対する代
謝の寄与率等の情報が限定的であること。
本薬とミダゾラムの臨床薬物相互作用試験における本薬の剤形は懸濁剤であるが、市販予定製剤は錠剤であることから、当該
PBPK モデルでは剤形の違いを考慮して、本薬の fa を、本薬懸濁剤及び本薬錠剤投与時の成績(6.2.1.2 参照)から、懸濁剤は
1、錠剤は 0.7 と設定している一方で、PPK 解析の最終モデル(6.2.4.1 参照)では本薬の fa に対する剤形の影響を考慮する必要
がないと判断されていること。
本薬の消失に対する CYP3A4 の寄与率について、反復投与時の蓄積率から推定した値(6.R.6.1 参照)が用いられており、強力
な CYP3A 阻害薬との臨床薬物相互作用試験は実施されておらず、本薬の消失に対する CYP3A4 の寄与率を検討するためのデ
ータは限定的である。また、PPK 解析においては、時間依存的阻害作用を考慮しないモデルが最終モデルとされ、時間依存的
阻害作用を考慮しないモデルでも本薬の反復投与後の血漿中濃度推移は記述可能であったとの説明もされており、当該設定値
については不確実性が伴うと考えること。
CYP3A4/5 に対する本薬の KI 及び kinact は、in vitro 試験(4.5.1 参照)の成績に基づき設定されている。一方で、本薬は in vitro 試
験において CYP3A4 に対する誘導作用も認められている(4.5.2 参照)ものの、本薬の CYP3A4/5 に対する誘導作用について、
当該 PBPK モデルでは考慮されていないこと。
本薬と CYP3A 基質薬併用投与時の PBPK モデルの検証について、本薬の申請用法・用量(375/125 mg)よりも高用量(750/250 mg)
で投与したときの臨床薬物相互作用試験成績に基づき行われており、本薬を申請用法・用量で投与したときの血漿中本薬曝露
域における本薬の CYP3A 阻害作用に係るモデルの検証は十分に行われていないこと。
本薬 750/250 mg 投与時の検討ではあるが、感度分析としてミクロソーム中の遊離型薬物分率(fu,mic)49)を 0.4~1.0 に変動させ
た場合のミダゾラムの AUCinf の予測上昇率は 5.12~10.5 倍と大きく変動すること。
本薬 750/250 mg を併用投与した場合のミダゾラム又はデキサメタゾンの血漿中濃度推移の予測において、ミダゾラム及びデキ
サメタゾンの血漿中濃度推移の実測値と予測値が一致していない傾向が認められており50)、当該不一致が本薬錠剤を申請用法・
用量(375/125 mg)で併用投与した場合のミダゾラムの PK の推定結果に与える影響も十分に検討されていないこと。
本薬の fu,gut は 0.000001 と設定されたが、当該パラメータの適切性については十分に説明されておらず、当該パラメータが他の
パラメータの設定や本薬錠剤を申請用法・用量(375/125 mg)で併用投与した場合のミダゾラムの PK の推定結果に与える影響
が検討されていないこと。
申請者は、以下のように説明した。
機構の意見を踏まえ、本薬を申請用法・用量で投与した場合のミダゾラムとの臨床薬物相互作用試験
を新たに実施する。本薬と CYP3A の基質薬との併用に係る注意喚起については、現時点では、併用時
に想定される最大のリスクを勘案し、750/250 mg とミダゾラムの臨床薬物相互作用試験におけるミダゾ
ラムの AUCinf の上昇率(8.80 倍、6.2.2 参照)及び他の強い CYP3A 阻害薬の添付文書も参考に併用禁忌
及び併用注意を設定し、当該試験結果が得られた後に再検討することとしたい。
機構は、申請者の説明を了承した。
6.R.6.2.2
本薬と P-gp、BCRP、OATP1B1、OATP1B3、OCT1 及び OAT3 の基質薬との併用について
申請者は、in vitro の検討において、本薬の P-gp、BCRP、OATP1B1、OATP1B3、OCT1 及び OAT3 阻
害作用が、「『医薬品開発と適正な情報提供のための薬物相互作用ガイドライン』について」(平成 30
年 7 月 23 日付け 薬生薬審発 0723 第 4 号)で規定されている臨床薬物相互作用試験の実施が考慮され
るカットオフ基準を超えたことを踏まえ、本薬と当該トランスポーターの基質薬との薬物相互作用につ
いて、以下のように説明している。
本薬と P-gp、BCRP、OATP1B1、OATP1B3 及び OCT1 の基質薬との薬物相互作用を検討するため、カ
クテル基質を用いた臨床薬物相互作用試験(T1215 試験)を実施した。総括報告書は未完成であるが、
PK 解析結果が得られており、本薬非併用時に対する本薬併用時の併用薬(ジゴキシン、ロスバスタチ
fu,mic は本薬 750/250 mg 投与とミダゾラムとの併用時におけるミダゾラムの AUCinf の上昇率(8.80 倍、6.2.2 参照)の成績に基づき、
0.5 と推定されている。
50)
当該不一致が生じた理由について、申請者は、臨床薬物相互作用試験(6.2.2 参照)で使用されたミダゾラム及びデキサメタゾンの製
剤[ミダゾラム:シロップ剤、デキサメタゾン:錠剤(国内市販製剤)]と、ミダゾラム及びデキサメタゾンの PBPK モデルの構築
に使用された製剤[ミダゾラム:錠剤(Clin Pharmacol Ther 1981; 30: 653-61)、デキサメタゾン:錠剤(海外市販製剤)(Eur Clin Respir
J 2017;4:1353395)]が異なるためと説明している。
49)
47
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
49 / 82