よむ、つかう、まなぶ。
【資料No.1】★審査報告書 (51 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
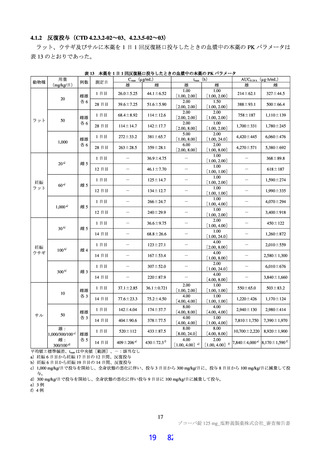
7.1
7.1.1
国際共同第Ⅱ/Ⅲ相試験(CTD 5.3.5.1-01:T1221 試験<2021 年 9 月~継続中>)
第Ⅱa 相パート<2021 年 9 月~2022 年 1 月>
無症状の SARS-CoV-2 病原体保有者及び SARS-CoV-2 による感染症患者[目標例数 69 例(各群 23
例)]を対象に、本薬の抗ウイルス活性及び安全性を検討することを目的として、プラセボ対照無作為
化二重盲検並行群間比較試験が、国内 56 施設で実施された。本試験の主な選択・除外基準は表 31 のと
おりであった。
表 31 主な選択・除外基準
12 歳以上 20 歳未満かつ体重 40 kg 以上又は 20 歳以上 70 歳未満 a)
SARS-CoV-2 陽性(無作為化前 120 時間以内に採取された検体を用いた PCR 検査等により確認)
SARS-CoV-2 による感染症の症状について、以下のいずれかを満たす
①症状あり(SARS-CoV-2 による感染症患者):以下をいずれも満たす
・ SARS-CoV-2 による感染症の症状(14 症状 b)のうち 1 つ以上)発現が無作為化前 120 時間以内
・ 無作為化時点において、SARS-CoV-2 による感染症の症状(12 症状)c)のうち、中等度(スコア 2)d)以上
選択基準
の症状が 1 つ以上認められる。ただし、SARS-CoV-2 による感染症の発症前から存在した症状である場合
は、SARS-CoV-2 による感染症により悪化したと被験者が判断した症状に限る e)
②症状なし(無症状の SARS-CoV-2 病原体保有者)
・ 無作為化前 2 週間以内に SARS-CoV-2 による感染症の症状(14 症状)b)がない。ただし、SARS-CoV-2 感染
前から存在した症状のうち、ベースライン時点で感染により悪化している症状がない場合は登録可能
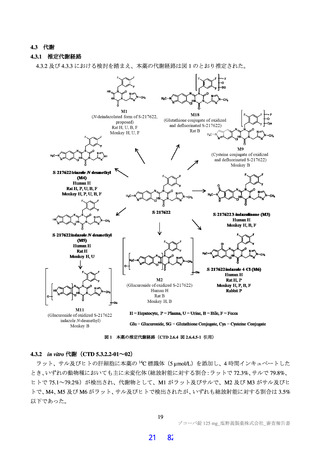
4.
治験薬投与開始~投与終了後少なくとも 10 日間避妊が可能な者
5.
(女性のみ)妊婦ではなく、妊娠している可能性もない者
1.
SpO2 が 93%以下(室内気)g)
2.
酸素投与を要する
除外基準 f) 3.
人工呼吸器を要する
4.
中等度以上(CTCAE 第 5.0 版 Grade 2 以上)の肝疾患の現病歴又は慢性病歴を有する
5.
中等度以上(CTCAE 第 5.0 版 Grade 2 以上)の腎疾患の現病歴又は慢性病歴を有する
a)プロトコル第 5 版(2021 年 10 月 19 日)で、20 歳以上 70 歳未満から 12 歳以上 70 歳未満(ただし、20 歳未満の場合は体重 40 kg 以
上の者に限る)に変更された。
b)①倦怠感又は疲労感、②筋肉痛又は体の痛み、③頭痛、④悪寒又は発汗、⑤熱っぽさ又は発熱、⑥鼻水又は鼻づまり、⑦喉の痛み、
⑧咳、⑨息切れ(呼吸困難)、⑩吐き気、⑪嘔吐、⑫下痢、⑬味覚異常、⑭嗅覚異常
c)①倦怠感又は疲労感、②筋肉痛又は体の痛み、③頭痛、④悪寒又は発汗、⑤熱っぽさ又は発熱、⑥鼻水又は鼻づまり、⑦喉の痛み、
⑧咳、⑨息切れ(呼吸困難)、⑩吐き気、⑪嘔吐、⑫下痢
d)症状のスコアを被験者本人が 4 段階(0:なし、1:軽度、2:中等度、3:重度)で評価
e)プロトコル第 5 版(2021 年 10 月 19 日)で「SARS-CoV-2 による感染症の発症前から存在した症状を除く」から変更された。
f)プロトコル第 5 版(2021 年 10 月 19 日)で「肺炎が強く疑われる者」が削除された。
g)プロトコル第 5 版(2021 年 10 月 19 日)で SpO2 が 96%以下(室内気)から 93%以下(室内気)に変更された。
1.
2.
3.
用法・用量は、①1 日目は本薬 375 mg を 1 日 1 回、2 日目から 5 日目は本薬 125 mg を 1 日 1 回経口
投与(以下、「本薬 375/125 mg 群」)、②1 日目は本薬 750 mg を 1 日 1 回、2 日目から 5 日目は本薬
250 mg を 1 日 1 回経口投与(以下、「本薬 750/250 mg 群」)、又は③プラセボを 1 日 1 回 5 日間経口
投与することとされた。
無作為化された 69 例(本薬 375/125 mg 群 22 例、本薬 750/250 mg 群 23 例、プラセボ群 24 例)のう
ち、治験薬が 1 回以上投与された 68 例(本薬 375/125 mg 群 21 例、本薬 750/250 mg 群 23 例、プラセボ
群 24 例)が安全性解析対象集団とされた。無作為化された 69 例のうち、投与開始日(治験薬投与前)
の鼻咽頭ぬぐい検体で RT-PCR が陽性かつベースラインの鼻咽頭ぬぐい検体51)において SARS-CoV-2 の
ウイルス力価が検出された 43 例(本薬 375/125 mg 群 15 例、本薬 750/250 mg 群 14 例、プラセボ群 14
例)が mITT 集団とされ、mITT 集団が抗ウイルス活性の解析対象集団とされた。なお、mITT 集団のう
ち、選択基準の症状なし(表 31 参照)に該当した被験者は各群 2 例であった。
試験中止例は 4 例(本薬 375/125 mg 群 1 例、プラセボ群 3 例)であり、中止理由の内訳は、疾患進行
1 例(プラセボ群)及び被験者の申し出 3 例(本薬 375/125 mg 群 1 例、プラセボ群 2 例)であった。
51)
治験薬初回投与開始前に得られた最終検体
49
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
51 / 82
7.1.1
国際共同第Ⅱ/Ⅲ相試験(CTD 5.3.5.1-01:T1221 試験<2021 年 9 月~継続中>)
第Ⅱa 相パート<2021 年 9 月~2022 年 1 月>
無症状の SARS-CoV-2 病原体保有者及び SARS-CoV-2 による感染症患者[目標例数 69 例(各群 23
例)]を対象に、本薬の抗ウイルス活性及び安全性を検討することを目的として、プラセボ対照無作為
化二重盲検並行群間比較試験が、国内 56 施設で実施された。本試験の主な選択・除外基準は表 31 のと
おりであった。
表 31 主な選択・除外基準
12 歳以上 20 歳未満かつ体重 40 kg 以上又は 20 歳以上 70 歳未満 a)
SARS-CoV-2 陽性(無作為化前 120 時間以内に採取された検体を用いた PCR 検査等により確認)
SARS-CoV-2 による感染症の症状について、以下のいずれかを満たす
①症状あり(SARS-CoV-2 による感染症患者):以下をいずれも満たす
・ SARS-CoV-2 による感染症の症状(14 症状 b)のうち 1 つ以上)発現が無作為化前 120 時間以内
・ 無作為化時点において、SARS-CoV-2 による感染症の症状(12 症状)c)のうち、中等度(スコア 2)d)以上
選択基準
の症状が 1 つ以上認められる。ただし、SARS-CoV-2 による感染症の発症前から存在した症状である場合
は、SARS-CoV-2 による感染症により悪化したと被験者が判断した症状に限る e)
②症状なし(無症状の SARS-CoV-2 病原体保有者)
・ 無作為化前 2 週間以内に SARS-CoV-2 による感染症の症状(14 症状)b)がない。ただし、SARS-CoV-2 感染
前から存在した症状のうち、ベースライン時点で感染により悪化している症状がない場合は登録可能
4.
治験薬投与開始~投与終了後少なくとも 10 日間避妊が可能な者
5.
(女性のみ)妊婦ではなく、妊娠している可能性もない者
1.
SpO2 が 93%以下(室内気)g)
2.
酸素投与を要する
除外基準 f) 3.
人工呼吸器を要する
4.
中等度以上(CTCAE 第 5.0 版 Grade 2 以上)の肝疾患の現病歴又は慢性病歴を有する
5.
中等度以上(CTCAE 第 5.0 版 Grade 2 以上)の腎疾患の現病歴又は慢性病歴を有する
a)プロトコル第 5 版(2021 年 10 月 19 日)で、20 歳以上 70 歳未満から 12 歳以上 70 歳未満(ただし、20 歳未満の場合は体重 40 kg 以
上の者に限る)に変更された。
b)①倦怠感又は疲労感、②筋肉痛又は体の痛み、③頭痛、④悪寒又は発汗、⑤熱っぽさ又は発熱、⑥鼻水又は鼻づまり、⑦喉の痛み、
⑧咳、⑨息切れ(呼吸困難)、⑩吐き気、⑪嘔吐、⑫下痢、⑬味覚異常、⑭嗅覚異常
c)①倦怠感又は疲労感、②筋肉痛又は体の痛み、③頭痛、④悪寒又は発汗、⑤熱っぽさ又は発熱、⑥鼻水又は鼻づまり、⑦喉の痛み、
⑧咳、⑨息切れ(呼吸困難)、⑩吐き気、⑪嘔吐、⑫下痢
d)症状のスコアを被験者本人が 4 段階(0:なし、1:軽度、2:中等度、3:重度)で評価
e)プロトコル第 5 版(2021 年 10 月 19 日)で「SARS-CoV-2 による感染症の発症前から存在した症状を除く」から変更された。
f)プロトコル第 5 版(2021 年 10 月 19 日)で「肺炎が強く疑われる者」が削除された。
g)プロトコル第 5 版(2021 年 10 月 19 日)で SpO2 が 96%以下(室内気)から 93%以下(室内気)に変更された。
1.
2.
3.
用法・用量は、①1 日目は本薬 375 mg を 1 日 1 回、2 日目から 5 日目は本薬 125 mg を 1 日 1 回経口
投与(以下、「本薬 375/125 mg 群」)、②1 日目は本薬 750 mg を 1 日 1 回、2 日目から 5 日目は本薬
250 mg を 1 日 1 回経口投与(以下、「本薬 750/250 mg 群」)、又は③プラセボを 1 日 1 回 5 日間経口
投与することとされた。
無作為化された 69 例(本薬 375/125 mg 群 22 例、本薬 750/250 mg 群 23 例、プラセボ群 24 例)のう
ち、治験薬が 1 回以上投与された 68 例(本薬 375/125 mg 群 21 例、本薬 750/250 mg 群 23 例、プラセボ
群 24 例)が安全性解析対象集団とされた。無作為化された 69 例のうち、投与開始日(治験薬投与前)
の鼻咽頭ぬぐい検体で RT-PCR が陽性かつベースラインの鼻咽頭ぬぐい検体51)において SARS-CoV-2 の
ウイルス力価が検出された 43 例(本薬 375/125 mg 群 15 例、本薬 750/250 mg 群 14 例、プラセボ群 14
例)が mITT 集団とされ、mITT 集団が抗ウイルス活性の解析対象集団とされた。なお、mITT 集団のう
ち、選択基準の症状なし(表 31 参照)に該当した被験者は各群 2 例であった。
試験中止例は 4 例(本薬 375/125 mg 群 1 例、プラセボ群 3 例)であり、中止理由の内訳は、疾患進行
1 例(プラセボ群)及び被験者の申し出 3 例(本薬 375/125 mg 群 1 例、プラセボ群 2 例)であった。
51)
治験薬初回投与開始前に得られた最終検体
49
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
51 / 82