よむ、つかう、まなぶ。
参考資料8 ヒト受精胚の作成を行う生殖補助医療研究に関する倫理指針ガイダンス(令和3年11月19日) (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29769.html |
| 出典情報 | ヒト受精胚等へのゲノム編集技術等を用いる研究に関する合同会議(再設置第4回 12/28)《厚生労働省》《文部科学省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
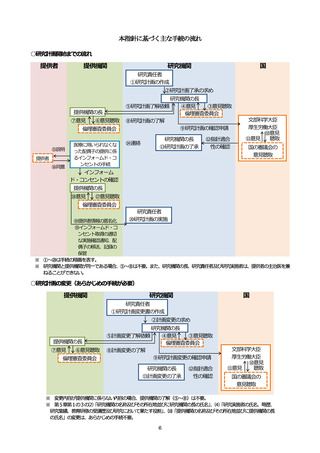
本指針に基づく主な手続の流れ
○研究計画開始までの流れ
提供者
提供機関
研究機関
国
研究責任者
①研究計画の作成
②研究計画了承の求め
提供機関の長
⑦意見
⑥意見聴取
倫理審査委員会
⑮説明
提供者
⑯同意
医療に用いられなくな
った配偶子の提供に係
るインフォームド・コ
ンセントの手続
研究機関の長
⑤研究計画了解依頼
④意見
③意見聴取
倫理審査委員会
⑧研究計画の了解
⑨研究計画の確認申請
研究機関の長
⑬研究計画の了承
⑭連絡
⑫指針適合
性の確認
文部科学大臣
厚生労働大臣
⑩意見
⑪意見
聴取
国の審議会の
意見聴取
インフォーム
ド・コンセントの確認
提供機関の長
⑱意見
⑰意見聴取
倫理審査委員会
研究責任者
⑳研究計画の実施
⑲提供者情報の匿名化
⑲インフォームド・コ
ンセント取得の適切
な実施確認通知、配
偶子の移送、記録の
保管
※ ①~⑳は手続の順番を表す。
※ 研究機関と提供機関が同一である場合、⑤~⑧は不要。また、研究機関の長、研究責任者及び研究実施者は、提供者の主治医を兼
ねることができない。
○研究計画の変更(あらかじめの手続が必要)
提供機関
研究機関
国
研究責任者
①研究計画変更書の作成
②計画変更の求め
提供機関の長
⑦意見
⑥意見聴取
倫理審査委員会
⑤計画変更了解依頼
研究機関の長
④意見
③意見聴取
倫理審査委員会
⑧計画変更の了解
⑨研究計画変更の確認申請
研究機関の長
⑬計画変更の了承
⑫指針適合
性の確認
文部科学大臣
厚生労働大臣
⑩意見
⑪意見
聴取
国の審議会の
意見聴取
※ 変更内容が提供機関に係らない内容の場合、提供機関の了解(⑤~⑧)は不要。
※ 第5章第1の3の⑵「研究機関の名称及びその所在地並びに研究機関の長の氏名」
、⑷「研究実施者の氏名、略歴、
研究業績、教育研修の受講歴及び研究において果たす役割」
、⑽「提供機関の名称及びその所在地並びに提供機関の長
の氏名」の変更は、あらかじめの手続不要。
6
○研究計画開始までの流れ
提供者
提供機関
研究機関
国
研究責任者
①研究計画の作成
②研究計画了承の求め
提供機関の長
⑦意見
⑥意見聴取
倫理審査委員会
⑮説明
提供者
⑯同意
医療に用いられなくな
った配偶子の提供に係
るインフォームド・コ
ンセントの手続
研究機関の長
⑤研究計画了解依頼
④意見
③意見聴取
倫理審査委員会
⑧研究計画の了解
⑨研究計画の確認申請
研究機関の長
⑬研究計画の了承
⑭連絡
⑫指針適合
性の確認
文部科学大臣
厚生労働大臣
⑩意見
⑪意見
聴取
国の審議会の
意見聴取
インフォーム
ド・コンセントの確認
提供機関の長
⑱意見
⑰意見聴取
倫理審査委員会
研究責任者
⑳研究計画の実施
⑲提供者情報の匿名化
⑲インフォームド・コ
ンセント取得の適切
な実施確認通知、配
偶子の移送、記録の
保管
※ ①~⑳は手続の順番を表す。
※ 研究機関と提供機関が同一である場合、⑤~⑧は不要。また、研究機関の長、研究責任者及び研究実施者は、提供者の主治医を兼
ねることができない。
○研究計画の変更(あらかじめの手続が必要)
提供機関
研究機関
国
研究責任者
①研究計画変更書の作成
②計画変更の求め
提供機関の長
⑦意見
⑥意見聴取
倫理審査委員会
⑤計画変更了解依頼
研究機関の長
④意見
③意見聴取
倫理審査委員会
⑧計画変更の了解
⑨研究計画変更の確認申請
研究機関の長
⑬計画変更の了承
⑫指針適合
性の確認
文部科学大臣
厚生労働大臣
⑩意見
⑪意見
聴取
国の審議会の
意見聴取
※ 変更内容が提供機関に係らない内容の場合、提供機関の了解(⑤~⑧)は不要。
※ 第5章第1の3の⑵「研究機関の名称及びその所在地並びに研究機関の長の氏名」
、⑷「研究実施者の氏名、略歴、
研究業績、教育研修の受講歴及び研究において果たす役割」
、⑽「提供機関の名称及びその所在地並びに提供機関の長
の氏名」の変更は、あらかじめの手続不要。
6