【資料No.1】2.5_臨床に関する概括資料 (127 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.5.5.2
2.5 臨床に関する概括評価
有害事象
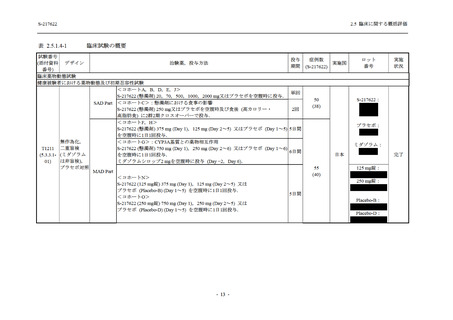
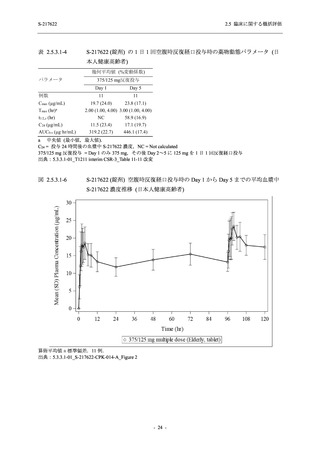
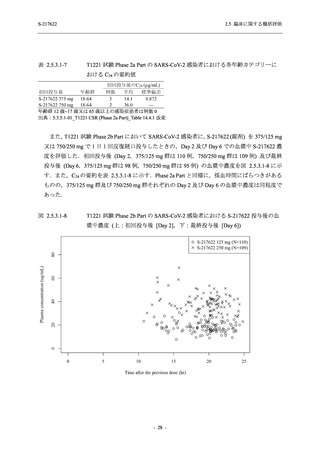
<Phase 2b Part>
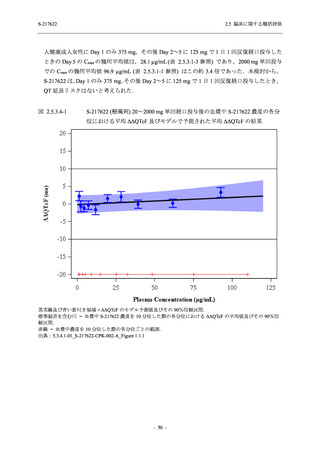
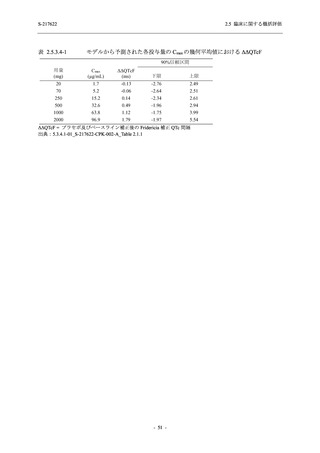
Phase 2b Part の開鍵時までの有害事象及び副作用の発現状況の概要を,それぞれ表 2.5.5.2-1
及び表 2.5.5.2-2 に示す.
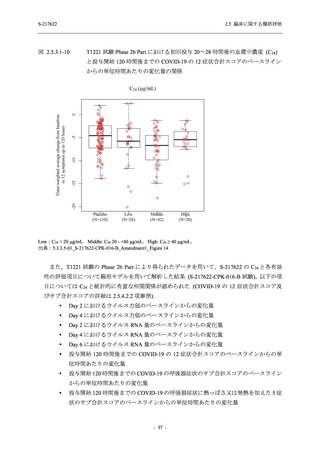
Phase 2b Part の軽症/中等症の SARS-CoV-2 感染者における有害事象の発現率は,375/125 mg
群 26.4% (37/140 例),750/250 mg 群 34.3% (48/140 例),プラセボ群 24.1% (34/141 例) (以下同順)
であった.また,副作用の発現率は 9.3% (13/140 例),18.6% (26/140 例),5.0% (7/141 例) であっ
た.有害事象の発現率は,375/125 mg 群ではプラセボ群と同程度で,750/250 mg 群ではプラセ
ボ群より高く,副作用の発現率は両群ともプラセボ群より高かった.本剤の用量群間では有害
事象及び副作用ともに 375/125 mg 群で低かった.本剤群で死亡,その他の重篤な有害事象は認
められなかったが,治験薬の投与中止に至った有害事象は 375/125 mg 群で 2 例に認められ,い
ずれも治験薬との因果関係ありと判断された.
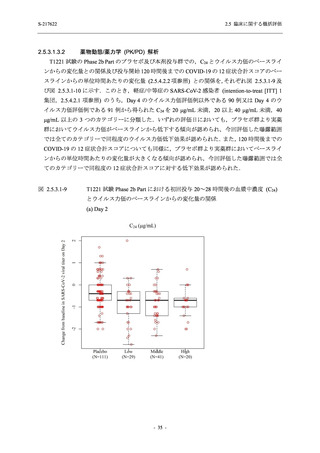
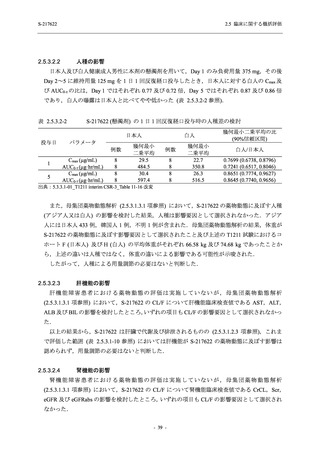
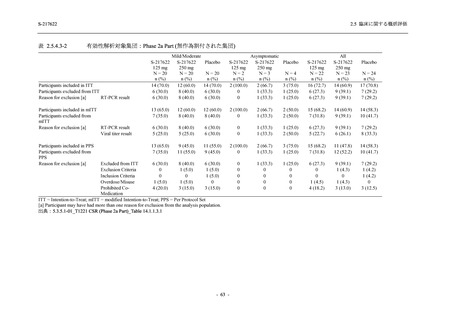
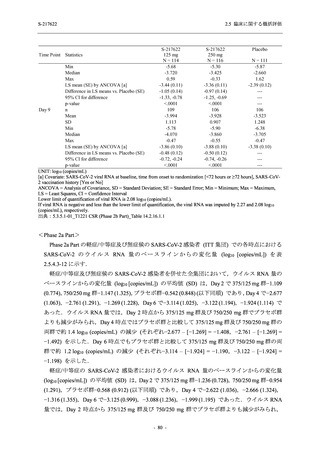
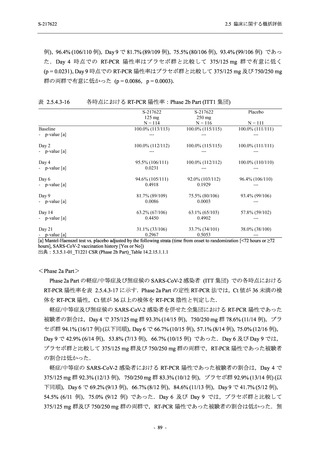
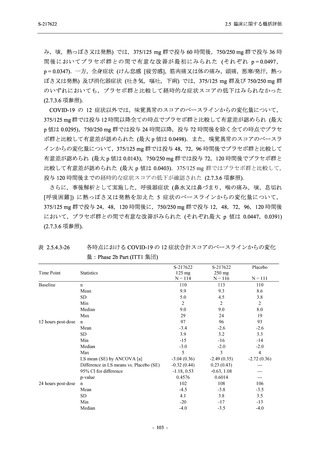
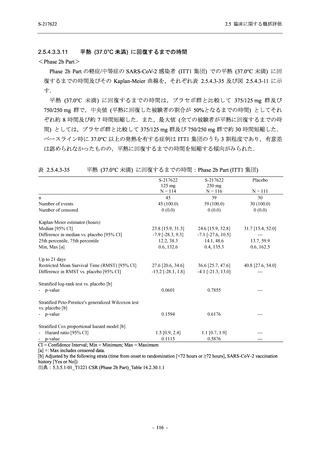
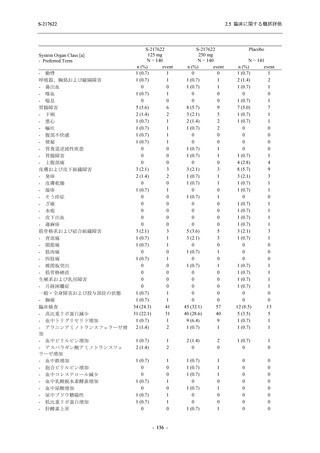
表 2.5.5.2-1
開鍵時の有害事象発現状況の概要:Phase 2b Part (安全性解析対象集団)
S-217622
125 mg
N = 140
S-217622
250 mg
N = 140
N = 141
37
(49)
26.4
[19.3, 34.5]
48
(70)
34.3
[26.5, 42.8]
34
(37)
24.1
[17.3, 32.0]
TEAEs with an outcome of death
- Number of participants
- (Number of events)
- Percentage of participants (%)
- 95% Confidence interval (%)
0
(0)
0.0
[0.0, 2.6]
0
(0)
0.0
[0.0, 2.6]
0
(0)
0.0
[0.0, 2.6]
Serious TEAEs other than deaths
- Number of participants
- (Number of events)
- Percentage of participants (%)
- 95% Confidence interval (%)
0
(0)
0.0
[0.0, 2.6]
0
(0)
0.0
[0.0, 2.6]
2
(2)
1.4
[0.2, 5.0]
Treatment-emergent adverse events
- Number of participants
- (Number of events)
- Percentage of participants (%)
- 95% Confidence interval (%)
Placebo
TEAEs leading to discontinuation of study
intervention
- Number of participants
2
0
0
- (Number of events)
(3)
(0)
(0)
- Percentage of participants (%)
1.4
0.0
0.0
- 95% Confidence interval (%)
[0.2, 5.1]
[0.0, 2.6]
[0.0, 2.6]
TEAE = Treatment-emergent Adverse Event
Treatment-emergent adverse events were defined as any AE reported after the first dose of the study intervention.
The confidence intervals were calculated by using Clopper-Pearson method.
出典:5.3.5.1-01_T1221 CSR (Phase 2b Part)_Table 14.3.1.1.1.1.1-1
- 127 -