【資料No.1】2.5_臨床に関する概括資料 (53 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.5 臨床に関する概括評価
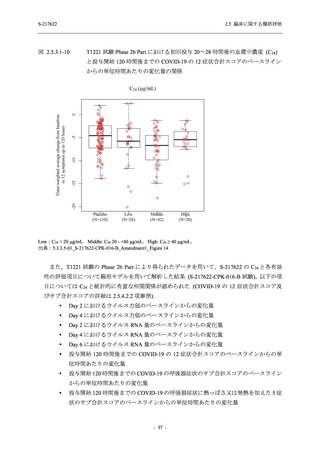
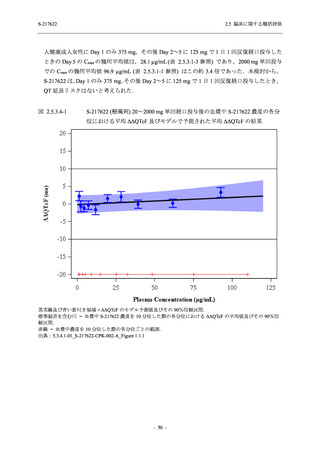
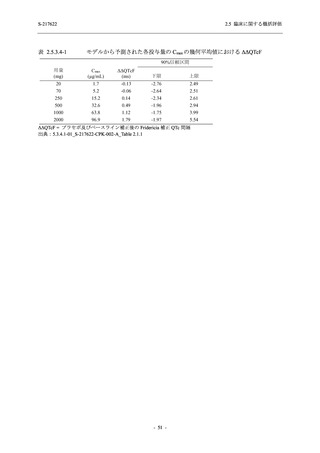
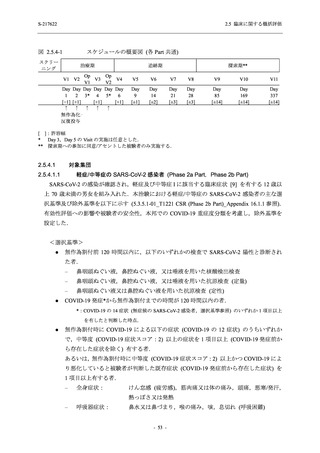
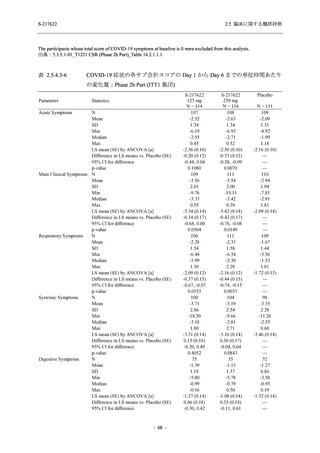
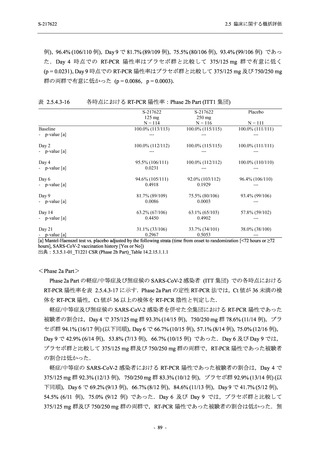
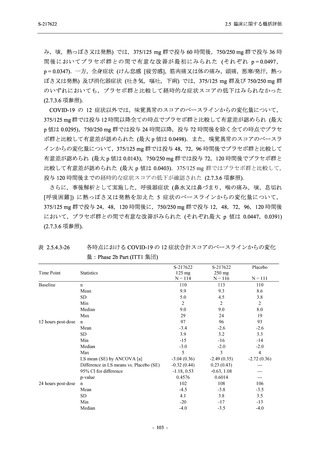
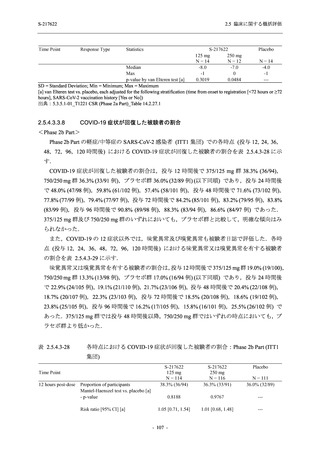
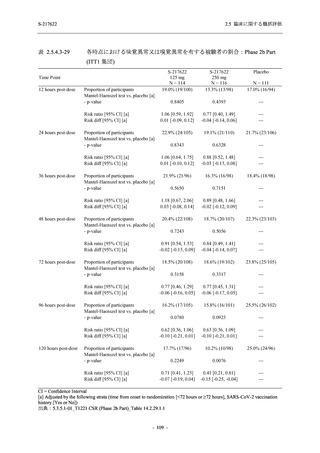
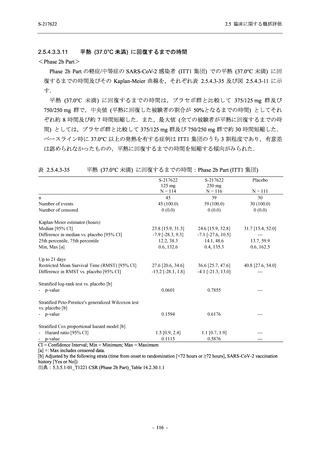
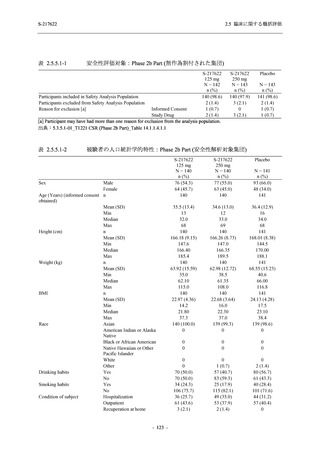
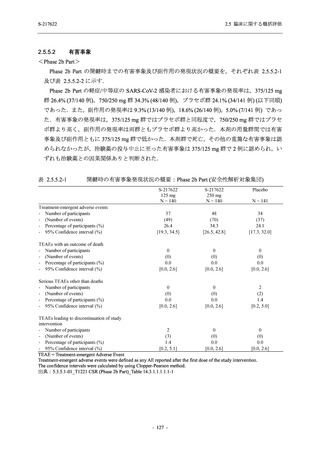
図 2.5.4-1
スケジュールの概要図 (各 Part 共通)
スクリー
ニング
治療期
Op
Op
V3
V4
V1
V2
Day Day Day Day Day Day
1
2 3* 4
5* 6
[−1] [+1]
[+1]
[+1]
↑ ↑ ↑ ↑ ↑
無作為化・
反復投与
V1 V2
追跡期
探索期**
V5
V6
V7
V8
V9
V10
V11
Day
9
[±1]
Day
14
[±2]
Day
21
[±3]
Day
28
[±3]
Day
85
[±14]
Day
169
[±14]
Day
337
[±14]
[ ]:許容幅
*
Day 3,Day 5 の Visit の実施は任意とした.
** 探索期への参加に同意/アセントした被験者のみ実施する.
2.5.4.1
対象集団
2.5.4.1.1
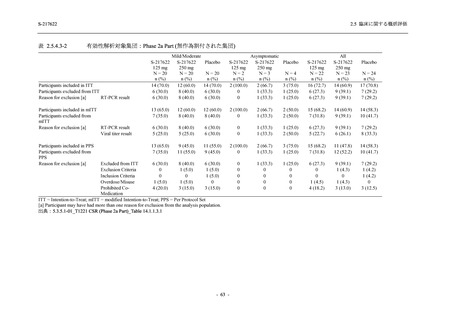
軽症/中等症の SARS-CoV-2 感染者 (Phase 2a Part,Phase 2b Part)
SARS-CoV-2 の感染が確認され,軽症及び中等症 I に該当する臨床症状 [9] を有する 12 歳以
上 70 歳未満の男女を組み入れた.本治験における軽症/中等症の SARS-CoV-2 感染者の主な選
択基準及び除外基準を以下に示す (5.3.5.1-01_T1221 CSR (Phase 2b Part)_Appendix 16.1.1 参照).
有効性評価への影響や被験者の安全性,本邦での COVID-19 重症度分類を考慮し,除外基準を
設定した.
<選択基準>
●
無作為割付前 120 時間以内に,以下のいずれかの検査で SARS-CoV-2 陽性と診断され
た者.
●
–
鼻咽頭ぬぐい液,鼻腔ぬぐい液,又は唾液を用いた核酸検出検査
–
鼻咽頭ぬぐい液,鼻腔ぬぐい液,又は唾液を用いた抗原検査 (定量)
–
鼻咽頭ぬぐい液又は鼻腔ぬぐい液を用いた抗原検査 (定性)
COVID-19 発症*から無作為割付までの時間が 120 時間以内の者.
*:COVID-19 の 14 症状 (無症候の SARS-CoV-2 感染者,選択基準参照) のいずれか 1 項目以上
を有したと判断した時点.
●
無作為割付時に COVID-19 による以下の症状 (COVID-19 の 12 症状) のうちいずれか
で,中等度 (COVID-19 症状スコア:2) 以上の症状を 1 項目以上 (COVID-19 発症前か
ら存在した症状を除く) 有する者.
あるいは,無作為割付時に中等度 (COVID-19 症状スコア:2) 以上かつ COVID-19 によ
り悪化していると被験者が判断した既存症状 (COVID-19 発症前から存在した症状) を
1 項目以上有する者.
–
全身症状:
けん怠感 (疲労感),筋肉痛又は体の痛み,頭痛,悪寒/発汗,
熱っぽさ又は発熱
–
呼吸器症状:
鼻水又は鼻づまり,喉の痛み,咳,息切れ (呼吸困難)
- 53 -