【資料No.1】2.5_臨床に関する概括資料 (144 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.5 臨床に関する概括評価
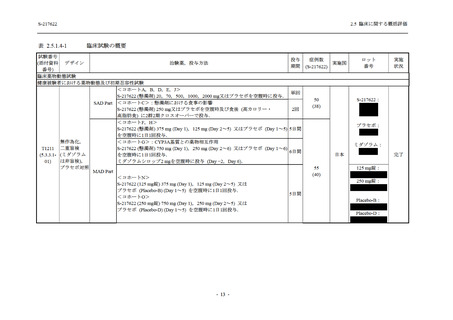
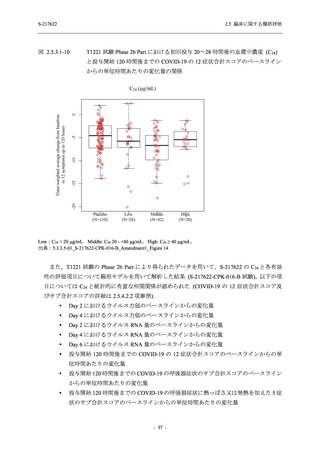
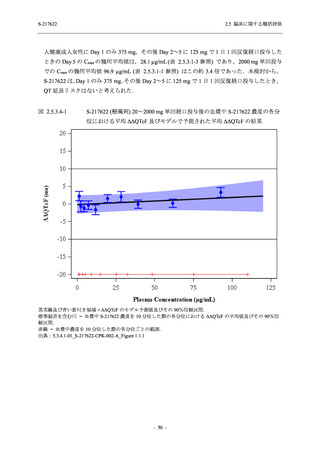
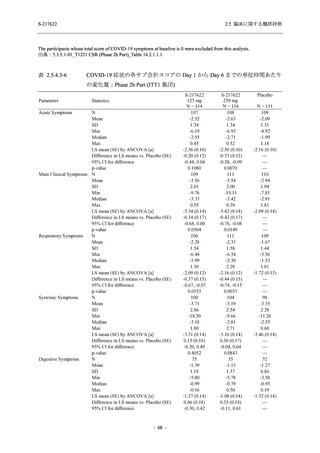
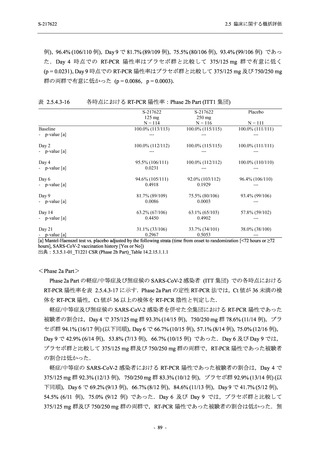
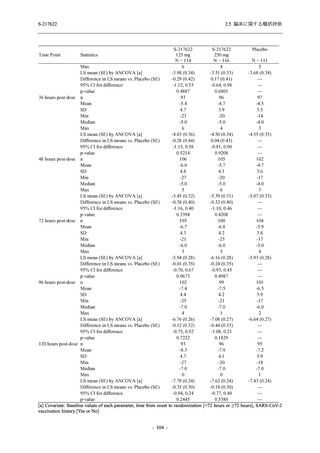
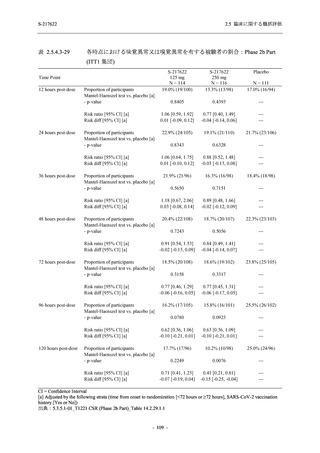
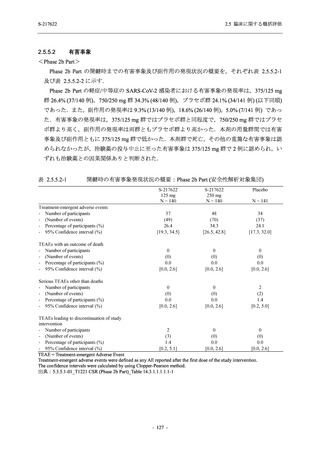
表 2.5.5.2-14
重症度別の有害事象:Phase 2a Part (安全性解析対象集団)
System Organ Class [a]
Severity
- Preferred Term
Participants with any
TEAE
Severe
Mild/Moderate
Asymptomatic
All
S-217622 S-217622 Placebo S-217622 S-217622 Placebo S-217622 S-217622 Placebo
125 mg 250 mg
125 mg 250 mg
125 mg 250 mg
N = 19 N = 20 N = 20 N = 2
N=3
N=4
N = 21 N = 23 N = 24
n (%)
n (%)
n (%)
n (%)
n (%)
n (%)
n (%)
n (%)
n (%)
0
0
0
0
0
0
0
0
0
Moderate 1 (5.3) 1 (5.0)
0
0
0
0
1 (4.8) 1 (4.3)
0
Mild
9 (47.4) 12 (60.0) 9 (45.0) 1 (50.0) 3 (100.0)
0
10 (47.6) 15 (65.2) 9 (37.5)
TEAE = Treatment-emergent Adverse Event
[a] System organ class and Preferred term of MedDRA Ver. 24.0
If a participant had experienced the same event more than once, the participant was counted once in the severest category
reported.
出典:5.3.5.1-01_T1221 CSR (Phase 2a Part)_Table 14.3.1.3.1.1
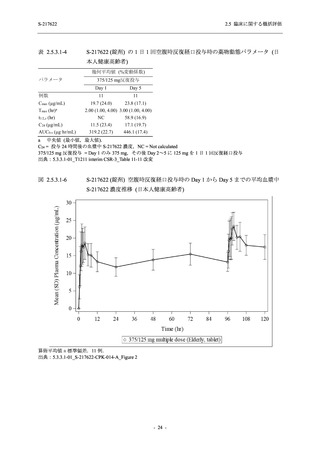
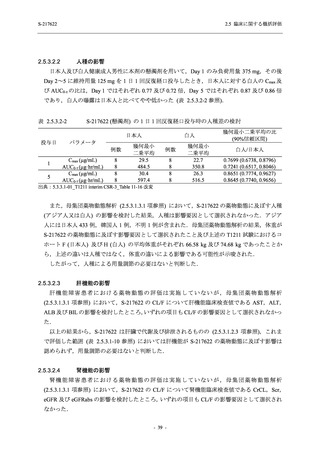
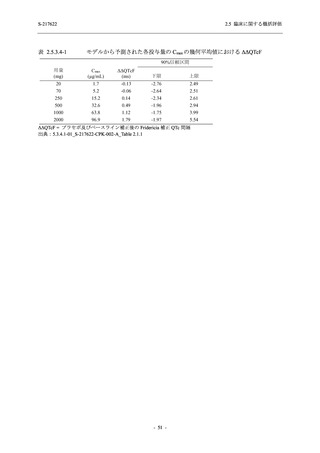
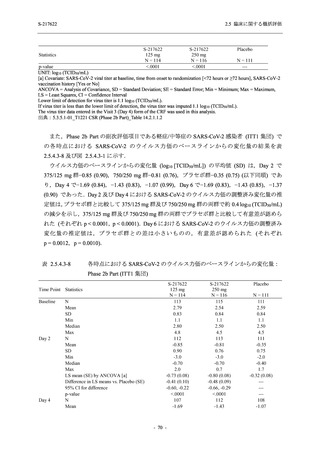
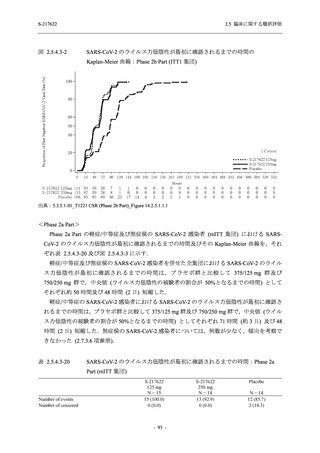
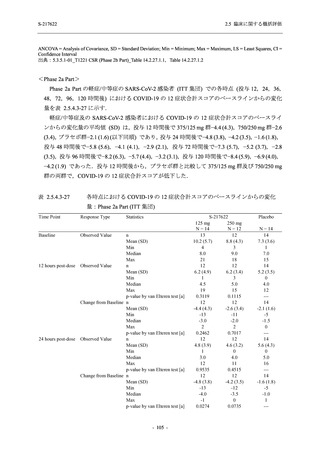
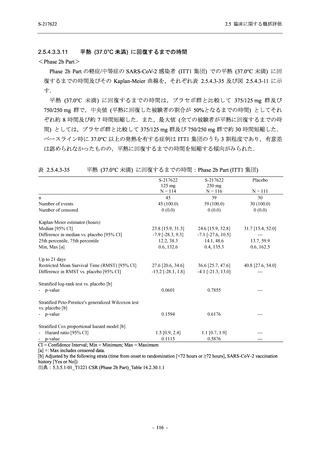
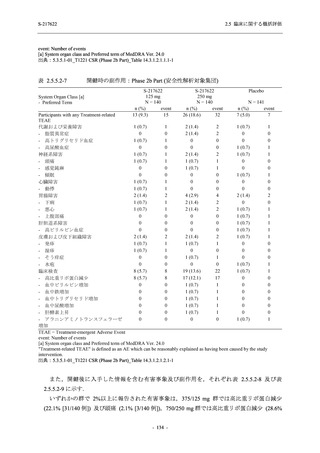
表 2.5.5.2-15
重症度別の副作用:Phase 2a Part (安全性解析対象集団)
System Organ Class [a]
Severity
- Preferred Term
Participants with any
Treatment-related
TEAE
Severe
Mild/Moderate
Asymptomatic
All
S-217622 S-217622 Placebo S-217622 S-217622 Placebo S-217622 S-217622 Placebo
125 mg 250 mg
125 mg 250 mg
125 mg 250 mg
N = 19 N = 20 N = 20
N=2
N=3
N=4
N = 21 N = 23 N = 24
n (%)
n (%)
n (%)
n (%)
n (%)
n (%)
n (%)
n (%)
n (%)
0
0
0
0
0
0
0
0
0
Moderate
0
0
0
0
0
0
0
0
0
Mild
5 (26.3) 7 (35.0)
0
0
3 (100.0)
0
5 (23.8) 10 (43.5)
0
TEAE = Treatment-emergent Adverse Event
[a] System organ class and Preferred term of MedDRA Ver. 24.0
"Treatment-related TEAE" is defined as an AE which can be reasonably explained as having been caused by the study
intervention.
If a participant had experienced the same event more than once, the participant was counted once in the severest category
reported.
出典:5.3.5.1-01_T1221 CSR (Phase 2a Part)_Table 14.3.1.3.1.2
2.5.5.2.1.3
転帰別
<Phase 2b Part>
開鍵後に入手した情報を含む転帰別の有害事象及び副作用の発現状況を表 2.5.5.2-16 及び表
2.5.5.2-17 に,事象別転帰別の有害事象及び副作用の発現状況を 2.7.4.7 項に示す.有害事象の多
くは回復又は軽快した.未回復の事象のうち,375/125 mg 群の血中トリグリセリド増加のみ治
験薬との因果関係ありと判断された.
- 144 -