【資料No.1】2.5_臨床に関する概括資料 (149 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
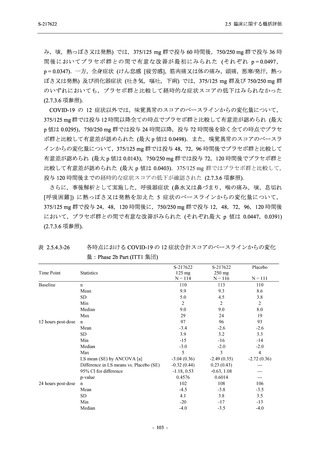
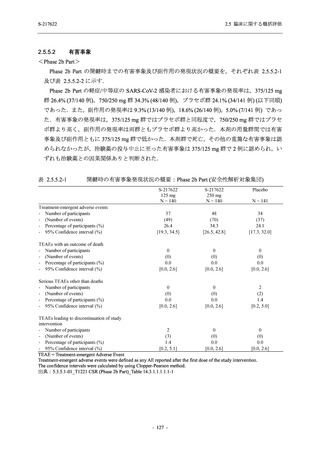
照) これらはいずれもゃ治験薬との因果関係ありと判断されたが, 治験薬の投与中止後に回復し
た (表 2.5.5.2-2, 5.3.7-01 T1221 Listing 16.2.7.1 参照).
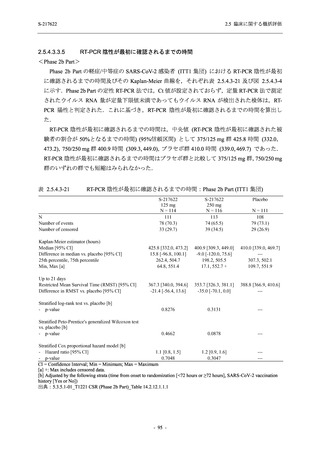
Phase 2a Part において., 治験薬の投与中止に至った有害事象は認められていない (表 2.5.5.2-$
参照).
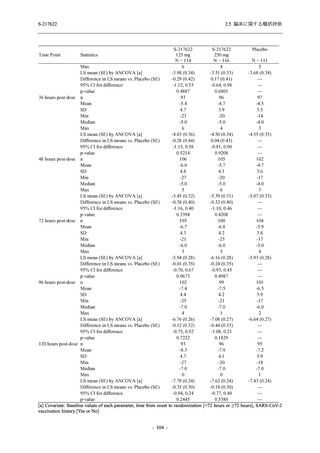
2.5.5.2.4 特記すべき有害事象
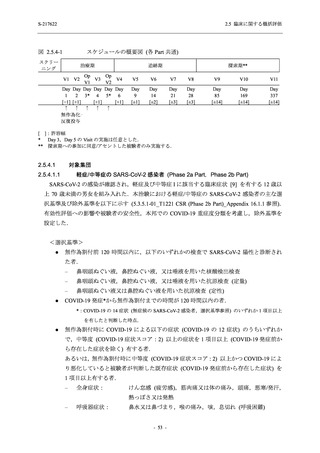
Phase 2b Part 及び Phase 2a Part において, 特記すべき有害事象は特定されていない.
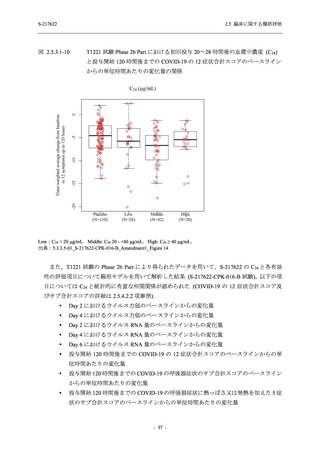
2.5.5.3 臨床検査値
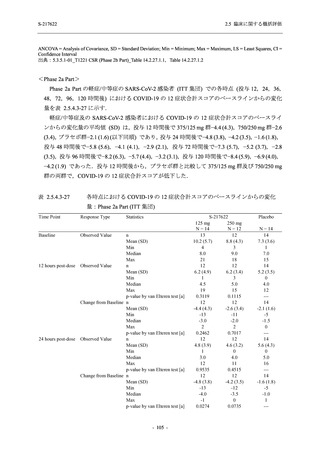
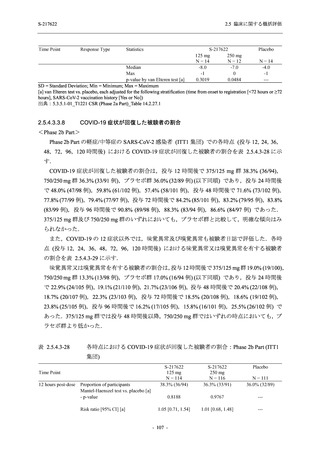
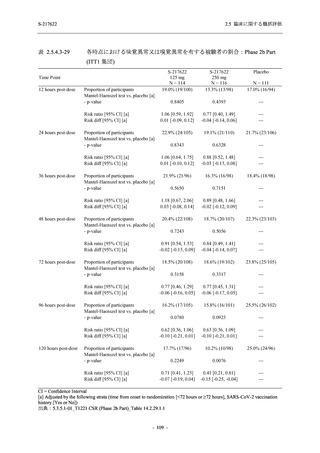
T1221 試験 Phase 2b Part 及びPhase 2a Part の臨床検査の各項目において, 高比重リポ看白の
減少.トリグリセリドの増加, 総ビリルビン及び直接ビリルビンの増加, 血清鉄の増加 (Phase 2b
Part のみ), 不飽和鉄結合能 (UIBC) の低下を除き, プラセボ群と比較して本剤群に特有な上昇
(増加) 又は低下 (減少) 傾向が認められる項目はなかった. 高比重リボポ蛋白, トリグリセリド,
総ビリルビン及び直接ビリルビンは, Day 6 で上昇 (増加) 又は低下 (減少) が認められたが,
Day 14 にはベースライン付近まで回復していたため, 一時的な変動と考えられた. また, 血清
鉄及びUIBC は, Day 6 で上昇 (増加) 又は低下 (減少) が認められたが, Phase 2a Part ではDay 28
で, Phase 2b Part では Day 114 でベースラインからの変化量が実薬群とプラセボ群で同程度で
あったため, 一時的な変動と考えられた. これらの検査値について, 用量間では, 375/12S ms 群
に比べ 7350/230 mg 群の方が上昇 (増加) 又は低下 (減少) の程度は大きかった (2.7.4.3.2 項参
照).
2.5.5.4 部分集団における有害事象
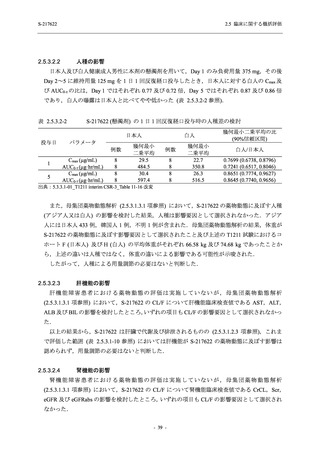
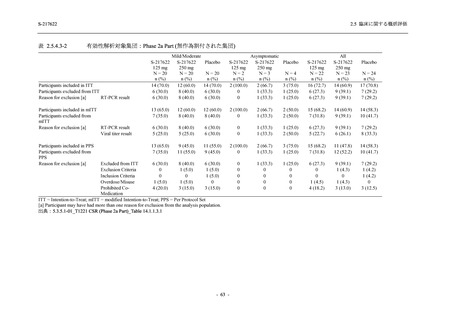
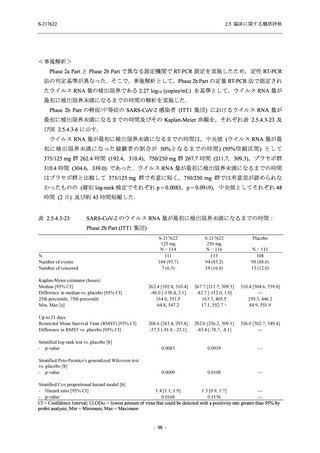
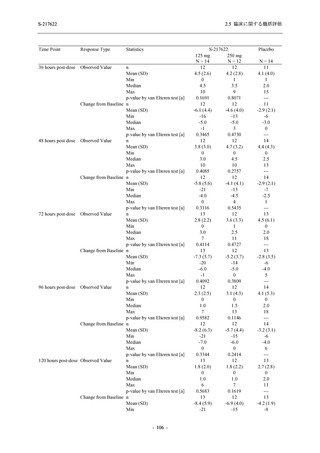
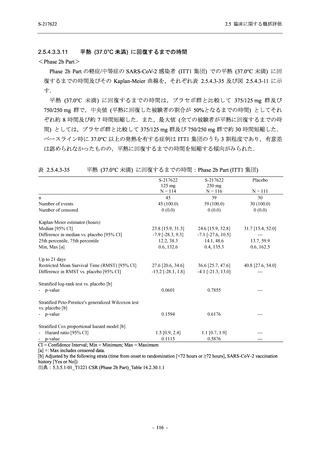
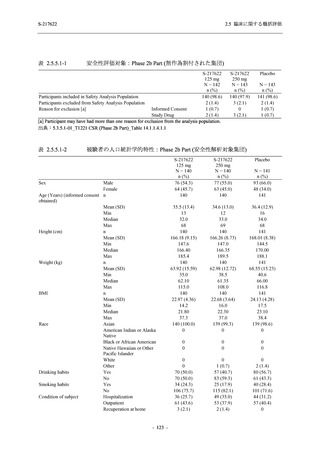
Phase 2b Part において, 年齢別 (20 歳未満, 20 歳以上 63 歳未満, 6$ 歳以上) で確認した. 20
歳未満の被験者では, 375/125 mg 群 7 例, 750/250ms 群 7 例,。 プラセボ和群 4 例が安全性解析対
象集団に含まれた (5.3.7-01 T1221 Listmg 16.2.3 参照)、373/125 mg 群の被験者に有害事象は報
告されず, 750/250mg 群の ]四歳, プラセボ和群の 冒歳, それぞれ 1 例に有害事象が報告された.
そのうち, 730/2S0msg 群の 直 歳に発現した血中ビリルビン増加及び血中鉄増加は治験薬との因
果関係ありと判断されたが, 重症度は軽度で, 医学的処置をすることなく回復した. 血中ビリ
ルビン増加及び血中鉄増加のいずれも, 成人においても報告されている事象であった. 本剤群
で治験薬との因果関係ありと判断された小児特有の事象はなかった (3.3.7-02_T1221 Listmg
16.2.7.1 参照)、 また, 65 歳以上の被験者では, 375/12S mg 群 1 例. 730/250mg 群 2 例, プラセ
ボ群 1 例が安全性解析対象集団に含まれた (3$.3.7-01 T1221 Listins 16.2.3 参照 375/125 mg 群
の被験者に有害事象は報告されず, 730/250mg 群の 眉歳, プラセボ群の 衝歳, それぞれ 1 例
に有害事象が報告されたが, いずれも治験薬との因果関係なしと判断された. 本剤群で治験薬
との因果関係ありと判断された高齢者特有の事象はなかった (3.3.7-02 T1221 Listing 16.2.7.1 参
照).
Phase 2a Part において, 年齢別 (20 歳未満, 20 歳以上 63 歳未満, 6$ 歳以上) では, 37S/12S mg
群に 購歳, プラセボ群に 1]冒歳の被験者が 1 例ずつ安全性解析対象集団に含まれ
- 149 -