よむ、つかう、まなぶ。
資料1-3 ニフェジピン 調査結果報告書及び添付文書 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29305.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第19回 11/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
調査結果報告書
令和 4 年 11 月 8 日
独立行政法人医薬品医療機器総合機構
I.
品目の概要
[一 般 名]
ニフェジピン
[販 売 名]
別添 1 のとおり
[承認取得者] 別添 1 のとおり
[効能・効果] 別添 1 のとおり
[用法・用量] 別添 1 のとおり
[調査担当部] 医薬品安全対策第一部
II. 今回の調査の経緯
厚生労働省は、
「妊婦・授乳婦を対象とした薬の適正使用推進事業」1において、医師、薬
剤師、生殖毒性の専門家等で構成される情報提供ワーキンググループ(以下、
「WG」
)を設
置し、国立成育医療研究センターの妊娠と薬情報センターに集積された情報等を評価・整理
し、妊婦・授乳婦(以下、
「妊婦等」)への医薬品投与に関する情報の添付文書への反映を推
進する取組を行っている。
ニフェジピン(以下、
「本薬」
)については、ラット、マウス等を用いた毒性試験において
催奇形性が確認されたため本薬の先発医薬品の製造販売承認時より禁忌に「妊婦又は妊娠
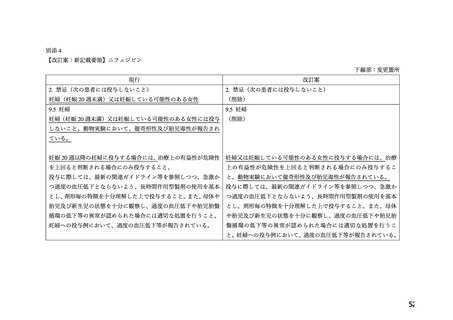
している可能性のある婦人」が設定された。平成 23 年(2011 年)に当該禁忌の見直しが検
討された結果、当該禁忌は「妊婦(妊娠 20 週未満)又は妊娠している可能性のある婦人」
に改訂された 2。
今般、妊娠全期間において厳格な血圧コントロールが求められるようになってきた医療
環境を踏まえ、WG により、積極的適応のない場合の高血圧に対して第一選択薬とされてい
る Ca 拮抗薬のうち医療現場での処方割合の高い本薬について、添付文書の禁忌「妊婦(妊
娠 20 週未満)又は妊娠している可能性のある婦人」の適正性が検討され、報告書(以下、
)
(別添 2)が取りまとめられた。WG 報告書を受けて、厚生労働省医薬・生
「WG 報告書」
活衛生局医薬安全対策課は、
「医薬品等の安全性に係る調査依頼について」
(令和 4 年 5 月
13 日付薬生安発 0513 第 4 号)により独立行政法人医薬品医療機器総合機構(以下、
「機構」)
に 本薬の妊産婦等に係る「使用上の注意」の改訂に関する調査を依頼した。機構は、当該依
1 医薬品・医療機器等安全性情報 No.355(厚生労働省医薬品・生活衛生局発行)
(https://www.mhlw.go.jp/content/11120000/000307752.pdf)(最終確認:2022 年 9 月 15 日)
2 平成 23 年度第 2 回薬事・食品衛生審議会医薬品等安全対策部会安全対策調査会 資料 1
(https://www.mhlw.go.jp/stf/shingi/2r9852000001hbq8.html)(最終確認:2022 年 9 月 15 日)
1
1
令和 4 年 11 月 8 日
独立行政法人医薬品医療機器総合機構
I.
品目の概要
[一 般 名]
ニフェジピン
[販 売 名]
別添 1 のとおり
[承認取得者] 別添 1 のとおり
[効能・効果] 別添 1 のとおり
[用法・用量] 別添 1 のとおり
[調査担当部] 医薬品安全対策第一部
II. 今回の調査の経緯
厚生労働省は、
「妊婦・授乳婦を対象とした薬の適正使用推進事業」1において、医師、薬
剤師、生殖毒性の専門家等で構成される情報提供ワーキンググループ(以下、
「WG」
)を設
置し、国立成育医療研究センターの妊娠と薬情報センターに集積された情報等を評価・整理
し、妊婦・授乳婦(以下、
「妊婦等」)への医薬品投与に関する情報の添付文書への反映を推
進する取組を行っている。
ニフェジピン(以下、
「本薬」
)については、ラット、マウス等を用いた毒性試験において
催奇形性が確認されたため本薬の先発医薬品の製造販売承認時より禁忌に「妊婦又は妊娠
している可能性のある婦人」が設定された。平成 23 年(2011 年)に当該禁忌の見直しが検
討された結果、当該禁忌は「妊婦(妊娠 20 週未満)又は妊娠している可能性のある婦人」
に改訂された 2。
今般、妊娠全期間において厳格な血圧コントロールが求められるようになってきた医療
環境を踏まえ、WG により、積極的適応のない場合の高血圧に対して第一選択薬とされてい
る Ca 拮抗薬のうち医療現場での処方割合の高い本薬について、添付文書の禁忌「妊婦(妊
娠 20 週未満)又は妊娠している可能性のある婦人」の適正性が検討され、報告書(以下、
)
(別添 2)が取りまとめられた。WG 報告書を受けて、厚生労働省医薬・生
「WG 報告書」
活衛生局医薬安全対策課は、
「医薬品等の安全性に係る調査依頼について」
(令和 4 年 5 月
13 日付薬生安発 0513 第 4 号)により独立行政法人医薬品医療機器総合機構(以下、
「機構」)
に 本薬の妊産婦等に係る「使用上の注意」の改訂に関する調査を依頼した。機構は、当該依
1 医薬品・医療機器等安全性情報 No.355(厚生労働省医薬品・生活衛生局発行)
(https://www.mhlw.go.jp/content/11120000/000307752.pdf)(最終確認:2022 年 9 月 15 日)
2 平成 23 年度第 2 回薬事・食品衛生審議会医薬品等安全対策部会安全対策調査会 資料 1
(https://www.mhlw.go.jp/stf/shingi/2r9852000001hbq8.html)(最終確認:2022 年 9 月 15 日)
1
1