よむ、つかう、まなぶ。
資料1-3 ニフェジピン 調査結果報告書及び添付文書 (49 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29305.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第19回 11/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
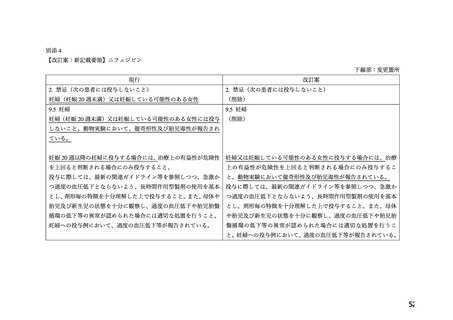
7.禁忌解除の妥当性
ワーキンググループにおいて、以下の理由から、妊娠 20 週未満の妊婦への本薬の投与について
は、「禁忌」の項から削除し、「妊婦への投与」の項において「治療上の有益性が危険性を上回る
と判断される場合にのみ投与する」旨の注意喚起を記載することが適切であると判断した。
① 本薬は、妊娠初期を含め妊娠中の降圧薬の第一選択薬又は第二選択薬として国内外のガイド
ラインで推奨されている。高血圧合併妊娠では母体の高血圧腎症や低出生体重児、新生児死
亡の割合が高い、など母児の予後が不良であることが示されている。妊娠高血圧症候群女性
987 人(高血圧合併妊娠 75%、妊娠高血圧 25%)を対象とした前向き介入研究で、血圧値を低
くコントロールした群で母児予後の改善を認めたため、妊娠全期間において厳格な血圧コン
トロールが求められるようになってきている。
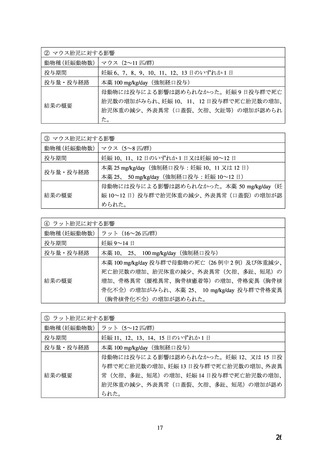
② 正常血圧動物(マウス、ラット及びウサギ)を用いた非臨床試験では、本薬 25mg/kg/day 以上
の高用量を投与した場合には胎児致死作用や指趾骨の異常等が発現する催奇形作用が認めら
れ、これらの毒作用は Ca 拮抗剤の薬理作用に基づく母動物の過度な血圧低下に伴う胎盤血
流量の減少等により発現すると考えられている。しかし、正常血圧動物(マウス、ラット及
びウサギ)を用いた非臨床試験においてヒトの 1 日臨床投与量の約 20 倍に相当する 10
mg/kg/day の用量では胚死亡や胎児の形態異常等は認められなかったこと、また、高血圧妊娠
ラットを用いた試験では、本薬 25 mg/kg/day を投与しても胎盤血流量の低下や胎児体重の減
少などがみられなかったことから、高血圧の状況下で用いられる臨床使用の条件下(妊婦の
過度な血圧低下を起こさない状況)においては、正常血圧動物試験でみられたような催奇形
作用等が発現することは考え難い。
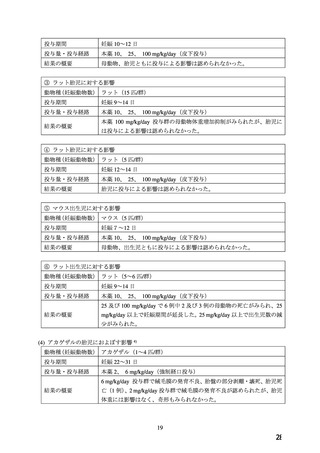
③ 欧州の催奇形性情報サービスによる、妊娠第1三半期に Ca 拮抗薬 299 例(本薬 76 例)に曝
露した妊婦を対象とした前向きコホート研究 3)において、大奇形の発生リスクについて対照
群との有意差は示されなかった。この他にも 40-300 例規模の複数の研究(加・米・英におけ
る催奇形性情報サービスによる、妊娠第1三半期に Ca 拮抗薬 78 例(本薬 34 例)に曝露した
妊婦を対象とした前向きコホート研究 1)、スウェーデンの出生レジストリデータベース情報
を利用した研究 4)
(Ca 拮抗薬 343 例、本薬 53 例)
)、イギリスの General Practice Research
Database を利用した研究 8)(Ca 拮抗薬 55 例)では、先天異常の発生リスクが示されなかっ
た。一方、アメリカ保険請求情報を利用した研究(Ca 拮抗薬 40 例)6)では、奇形全体の発
生率は上昇させないものの、上部消化管奇形との関連が示された。ハンガリーの国家レジス
トリを用いた症例対照研究 2)11)では、動物実験でみられた四肢異常やアメリカ保険請求情
報を利用した研究 6)でリスクが上昇することが示された上部消化管奇形との関連について
検証したが、これらを支持する結果は得られなかった。ハンガリーの国家レジストリを用い
た症例対照研究で右心系の狭窄・閉塞病変との関連について認めたとの報告 9)があるが、器
官形成期の曝露を対象としていない。コロンビアで行われた頭蓋顔面奇形 361 例と対照 719
例を解析した症例対照研究 5)では、本剤曝露群で発生率が数倍になることが示されたが、著
者らは、本薬は早産に使用される医薬品であり、この結果は交絡によるものと考察している。
また、本薬の曝露時期が明記されていない。この他に、米・加で行った先天奇形 5568 例と対
39
48
ワーキンググループにおいて、以下の理由から、妊娠 20 週未満の妊婦への本薬の投与について
は、「禁忌」の項から削除し、「妊婦への投与」の項において「治療上の有益性が危険性を上回る
と判断される場合にのみ投与する」旨の注意喚起を記載することが適切であると判断した。
① 本薬は、妊娠初期を含め妊娠中の降圧薬の第一選択薬又は第二選択薬として国内外のガイド
ラインで推奨されている。高血圧合併妊娠では母体の高血圧腎症や低出生体重児、新生児死
亡の割合が高い、など母児の予後が不良であることが示されている。妊娠高血圧症候群女性
987 人(高血圧合併妊娠 75%、妊娠高血圧 25%)を対象とした前向き介入研究で、血圧値を低
くコントロールした群で母児予後の改善を認めたため、妊娠全期間において厳格な血圧コン
トロールが求められるようになってきている。
② 正常血圧動物(マウス、ラット及びウサギ)を用いた非臨床試験では、本薬 25mg/kg/day 以上
の高用量を投与した場合には胎児致死作用や指趾骨の異常等が発現する催奇形作用が認めら
れ、これらの毒作用は Ca 拮抗剤の薬理作用に基づく母動物の過度な血圧低下に伴う胎盤血
流量の減少等により発現すると考えられている。しかし、正常血圧動物(マウス、ラット及
びウサギ)を用いた非臨床試験においてヒトの 1 日臨床投与量の約 20 倍に相当する 10
mg/kg/day の用量では胚死亡や胎児の形態異常等は認められなかったこと、また、高血圧妊娠
ラットを用いた試験では、本薬 25 mg/kg/day を投与しても胎盤血流量の低下や胎児体重の減
少などがみられなかったことから、高血圧の状況下で用いられる臨床使用の条件下(妊婦の
過度な血圧低下を起こさない状況)においては、正常血圧動物試験でみられたような催奇形
作用等が発現することは考え難い。
③ 欧州の催奇形性情報サービスによる、妊娠第1三半期に Ca 拮抗薬 299 例(本薬 76 例)に曝
露した妊婦を対象とした前向きコホート研究 3)において、大奇形の発生リスクについて対照
群との有意差は示されなかった。この他にも 40-300 例規模の複数の研究(加・米・英におけ
る催奇形性情報サービスによる、妊娠第1三半期に Ca 拮抗薬 78 例(本薬 34 例)に曝露した
妊婦を対象とした前向きコホート研究 1)、スウェーデンの出生レジストリデータベース情報
を利用した研究 4)
(Ca 拮抗薬 343 例、本薬 53 例)
)、イギリスの General Practice Research
Database を利用した研究 8)(Ca 拮抗薬 55 例)では、先天異常の発生リスクが示されなかっ
た。一方、アメリカ保険請求情報を利用した研究(Ca 拮抗薬 40 例)6)では、奇形全体の発
生率は上昇させないものの、上部消化管奇形との関連が示された。ハンガリーの国家レジス
トリを用いた症例対照研究 2)11)では、動物実験でみられた四肢異常やアメリカ保険請求情
報を利用した研究 6)でリスクが上昇することが示された上部消化管奇形との関連について
検証したが、これらを支持する結果は得られなかった。ハンガリーの国家レジストリを用い
た症例対照研究で右心系の狭窄・閉塞病変との関連について認めたとの報告 9)があるが、器
官形成期の曝露を対象としていない。コロンビアで行われた頭蓋顔面奇形 361 例と対照 719
例を解析した症例対照研究 5)では、本剤曝露群で発生率が数倍になることが示されたが、著
者らは、本薬は早産に使用される医薬品であり、この結果は交絡によるものと考察している。
また、本薬の曝露時期が明記されていない。この他に、米・加で行った先天奇形 5568 例と対
39
48