よむ、つかう、まなぶ。
資料1-3 ニフェジピン 調査結果報告書及び添付文書 (64 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29305.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第19回 11/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2021年 4 月改訂(第 1 版)
日本標準商品分類番号
872171
貯法:室温保存
有効期間:3年
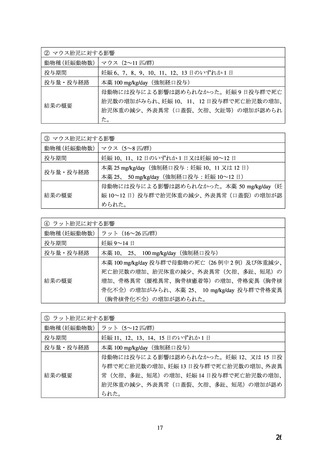
Rカプセル10
Rカプセル20
承認番号
16100AMZ03456000
16300AMZ00536000
販売開始
1986年12月
1988年 9 月
カルシウム拮抗剤・ニフェジピン持効性製剤
日本薬局方
ニフェジピン徐放カプセル
劇薬
処方箋医薬品注)
SEPAMIT®-RCapsules
注)注意―医師等の処方箋により使用すること
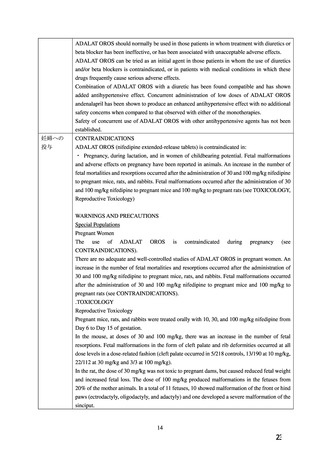
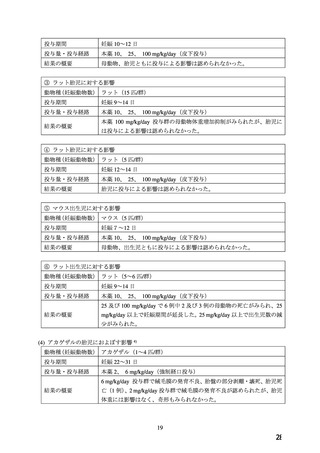
2. 禁忌(次の患者には投与しないこと)
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 妊婦(妊娠20週未満)又は妊娠している可能性のある女
性[9.5.1 参照]
2.3 心原性ショックの患者[血圧低下により症状が悪化する
おそれがある。]
3. 組成・性状
3.1 組成
販売名
成分・含量
(1カプセル中)
セパミット®-R
日局 ニフェジピン
カプセル10
セパミット®-R
日局 ニフェジピン
カプセル20
添加剤
トウモロコシデンプン、白糖、ヒドロ
10.0mg
キシプロピルセルロース、その他4成分
カプセル本体:黄色5号、ラウリル硫酸
20.0mg
ナトリウム
3.2 製剤の性状
販売名
色・剤形
硬カプセル
セパミット®-R
(キャップ濃いだいだい
カプセル10
色、ボディだいだい色)
硬カプセル
セパミット®-R
(キャップ濃いだいだい
カプセル20
色、ボディだいだい色)
外形・大きさ・重量
大きさ
4号カプセル
重量
170mg
大きさ
2号カプセル
重量
325mg
本体表示
セパミットR 10
JG
セパミットR 20
JG
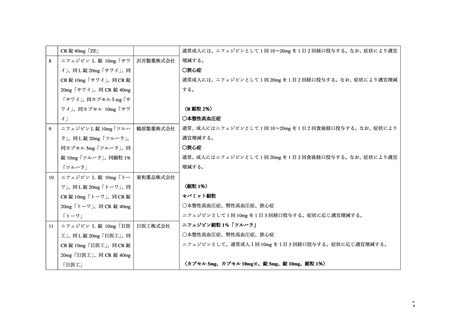
4. 効能又は効果
○本態性高血圧症、腎性高血圧症
○狭心症
6. 用法及び用量
〈本態性高血圧症、腎性高血圧症〉
通常成人には、ニフェジピンとして1回10〜20mgを1日2回経口
投与する。なお、症状により適宜増減する。
〈狭心症〉
通常成人には、ニフェジピンとして1回20mgを1日2回経口投与
する。なお、症状により適宜増減する。
8. 重要な基本的注意
8.1 カルシウム拮抗剤の投与を急に中止したとき、症状が悪化し
た症例が報告されているので、本剤の休薬を要する場合は徐々
に減量し、観察を十分に行うこと。また患者に医師の指示なし
に服薬を中止しないように注意すること1)。
8.2 まれに過度の血圧低下を起こし、ショック症状や一過性の意
識障害、脳梗塞があらわれることがあるので、そのような場合
には投与を中止し、適切な処置を行うこと。
8.3 降圧作用に基づくめまい等があらわれることがあるので、高
所作業、自動車の運転等危険を伴う機械を操作する際には注意
させること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 大動脈弁狭窄、僧帽弁狭窄のある患者、肺高血圧のある患者
血管拡張作用により重篤な血行動態の悪化を招くおそれがある。
9.1.2 過度に血圧の低い患者
さらに血圧が低下するおそれがある。
-1-
9.1.3 血液透析療法中の循環血液量減少を伴う高血圧患者
過度に血圧が低下するおそれがある。
9.1.4 うっ血性心不全(特に高度の左室収縮機能障害)のある患者
心不全が悪化するおそれがある2)。
9.2 腎機能障害患者
9.2.1 重篤な腎機能障害のある患者
急速な降圧等により腎機能が悪化するおそれがある。
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害のある患者
血中濃度が上昇することがある。また門脈圧が上昇するおそれ
がある3)。
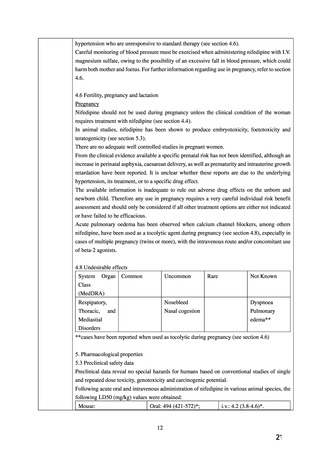
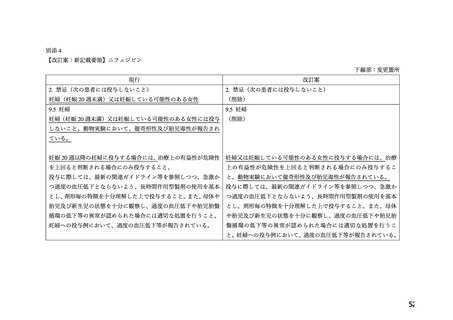
9.5 妊婦
9.5.1 妊婦(妊娠20週未満)又は妊娠している可能性のある女性
には投与しないこと。動物実験において、催奇形性及び胎児毒
性が報告されている。[2.2 参照]
9.5.2 妊娠20週以降の妊婦に投与する場合には、治療上の有益性
が危険性を上回ると判断される場合にのみ投与すること。
投与に際しては、最新の関連ガイドライン等を参照しつつ、急
激かつ過度の血圧低下とならないよう、長時間作用型製剤の使
用を基本とし、剤形毎の特徴を十分理解した上で投与すること。
また、母体や胎児及び新生児の状態を十分に観察し、過度の血
圧低下や胎児胎盤循環の低下等の異常が認められた場合には適
切な処置を行うこと。妊婦への投与例において、過度の血圧低
下等が報告されている。
9.5.3 硫酸マグネシウム水和物の注射剤を併用する場合には、血
圧等を注意深くモニタリングすること。[10.2 参照]
9.6 授乳婦
授乳しないことが望ましい。ヒト母乳中へ移行することが報告
されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
高齢者では低用量から投与を開始するなど患者の状態を観察し
ながら慎重に投与すること。一般に過度の降圧は好ましくない
とされている。脳梗塞等が起こるおそれがある。
10. 相互作用
本剤は主にチトクロームP450 3A4(CYP3A4)により代謝され
る。[16.4 参照]
10.2 併用注意(併用に注意すること)
薬剤名等
他の降圧剤
レセルピン
メチルドパ
プラゾシン塩酸塩等
臨床症状・措置方法
機序・危険因子
相互に血圧低下作用を増強す 薬理学的な相加・相乗作用に
よるものと考えられている。
ることがある。
患者の状態を注意深く観察
し、過度の血圧低下が認めら
れた場合、本剤又は他の降圧
剤を減量若しくは中止するな
ど適切な処置を行う。
相互に作用を増強することが 薬理学的な相加・相乗作用に
β遮断剤
よるものと考えられている。
ある。
アテノロール
アセブトロール塩酸塩 患 者 の 状 態 を 注 意 深 く 観 察
プロプラノロール塩酸 し、過度の血圧低下や心不全
等の症状が認められた場合、
塩等
本剤又はβ遮断剤を減量若し
くは中止するなど適切な処置
を行う。
63
日本標準商品分類番号
872171
貯法:室温保存
有効期間:3年
Rカプセル10
Rカプセル20
承認番号
16100AMZ03456000
16300AMZ00536000
販売開始
1986年12月
1988年 9 月
カルシウム拮抗剤・ニフェジピン持効性製剤
日本薬局方
ニフェジピン徐放カプセル
劇薬
処方箋医薬品注)
SEPAMIT®-RCapsules
注)注意―医師等の処方箋により使用すること
2. 禁忌(次の患者には投与しないこと)
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 妊婦(妊娠20週未満)又は妊娠している可能性のある女
性[9.5.1 参照]
2.3 心原性ショックの患者[血圧低下により症状が悪化する
おそれがある。]
3. 組成・性状
3.1 組成
販売名
成分・含量
(1カプセル中)
セパミット®-R
日局 ニフェジピン
カプセル10
セパミット®-R
日局 ニフェジピン
カプセル20
添加剤
トウモロコシデンプン、白糖、ヒドロ
10.0mg
キシプロピルセルロース、その他4成分
カプセル本体:黄色5号、ラウリル硫酸
20.0mg
ナトリウム
3.2 製剤の性状
販売名
色・剤形
硬カプセル
セパミット®-R
(キャップ濃いだいだい
カプセル10
色、ボディだいだい色)
硬カプセル
セパミット®-R
(キャップ濃いだいだい
カプセル20
色、ボディだいだい色)
外形・大きさ・重量
大きさ
4号カプセル
重量
170mg
大きさ
2号カプセル
重量
325mg
本体表示
セパミットR 10
JG
セパミットR 20
JG
4. 効能又は効果
○本態性高血圧症、腎性高血圧症
○狭心症
6. 用法及び用量
〈本態性高血圧症、腎性高血圧症〉
通常成人には、ニフェジピンとして1回10〜20mgを1日2回経口
投与する。なお、症状により適宜増減する。
〈狭心症〉
通常成人には、ニフェジピンとして1回20mgを1日2回経口投与
する。なお、症状により適宜増減する。
8. 重要な基本的注意
8.1 カルシウム拮抗剤の投与を急に中止したとき、症状が悪化し
た症例が報告されているので、本剤の休薬を要する場合は徐々
に減量し、観察を十分に行うこと。また患者に医師の指示なし
に服薬を中止しないように注意すること1)。
8.2 まれに過度の血圧低下を起こし、ショック症状や一過性の意
識障害、脳梗塞があらわれることがあるので、そのような場合
には投与を中止し、適切な処置を行うこと。
8.3 降圧作用に基づくめまい等があらわれることがあるので、高
所作業、自動車の運転等危険を伴う機械を操作する際には注意
させること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 大動脈弁狭窄、僧帽弁狭窄のある患者、肺高血圧のある患者
血管拡張作用により重篤な血行動態の悪化を招くおそれがある。
9.1.2 過度に血圧の低い患者
さらに血圧が低下するおそれがある。
-1-
9.1.3 血液透析療法中の循環血液量減少を伴う高血圧患者
過度に血圧が低下するおそれがある。
9.1.4 うっ血性心不全(特に高度の左室収縮機能障害)のある患者
心不全が悪化するおそれがある2)。
9.2 腎機能障害患者
9.2.1 重篤な腎機能障害のある患者
急速な降圧等により腎機能が悪化するおそれがある。
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害のある患者
血中濃度が上昇することがある。また門脈圧が上昇するおそれ
がある3)。
9.5 妊婦
9.5.1 妊婦(妊娠20週未満)又は妊娠している可能性のある女性
には投与しないこと。動物実験において、催奇形性及び胎児毒
性が報告されている。[2.2 参照]
9.5.2 妊娠20週以降の妊婦に投与する場合には、治療上の有益性
が危険性を上回ると判断される場合にのみ投与すること。
投与に際しては、最新の関連ガイドライン等を参照しつつ、急
激かつ過度の血圧低下とならないよう、長時間作用型製剤の使
用を基本とし、剤形毎の特徴を十分理解した上で投与すること。
また、母体や胎児及び新生児の状態を十分に観察し、過度の血
圧低下や胎児胎盤循環の低下等の異常が認められた場合には適
切な処置を行うこと。妊婦への投与例において、過度の血圧低
下等が報告されている。
9.5.3 硫酸マグネシウム水和物の注射剤を併用する場合には、血
圧等を注意深くモニタリングすること。[10.2 参照]
9.6 授乳婦
授乳しないことが望ましい。ヒト母乳中へ移行することが報告
されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
高齢者では低用量から投与を開始するなど患者の状態を観察し
ながら慎重に投与すること。一般に過度の降圧は好ましくない
とされている。脳梗塞等が起こるおそれがある。
10. 相互作用
本剤は主にチトクロームP450 3A4(CYP3A4)により代謝され
る。[16.4 参照]
10.2 併用注意(併用に注意すること)
薬剤名等
他の降圧剤
レセルピン
メチルドパ
プラゾシン塩酸塩等
臨床症状・措置方法
機序・危険因子
相互に血圧低下作用を増強す 薬理学的な相加・相乗作用に
よるものと考えられている。
ることがある。
患者の状態を注意深く観察
し、過度の血圧低下が認めら
れた場合、本剤又は他の降圧
剤を減量若しくは中止するな
ど適切な処置を行う。
相互に作用を増強することが 薬理学的な相加・相乗作用に
β遮断剤
よるものと考えられている。
ある。
アテノロール
アセブトロール塩酸塩 患 者 の 状 態 を 注 意 深 く 観 察
プロプラノロール塩酸 し、過度の血圧低下や心不全
等の症状が認められた場合、
塩等
本剤又はβ遮断剤を減量若し
くは中止するなど適切な処置
を行う。
63