よむ、つかう、まなぶ。
資料1-3 ニフェジピン 調査結果報告書及び添付文書 (61 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29305.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第19回 11/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
注1)
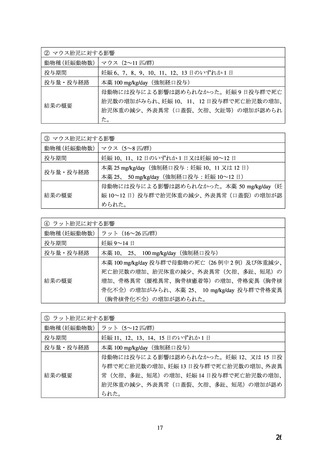
*4.副作用
承認時及び使用成績調査での調査症例5,745例中639例
(11.1
%)
に副作用
(臨床検査値の異常変動を含む)
が認められ,主
な副作用は頭痛・頭重感159例(2.8%),顔面潮紅・顔のほ
てり130例
(2.3%)
,動悸75例
(1.3%)
であった.
(再審査終了
時)
40mg 1 日 1 回で降圧効果不十分な本態性高血圧症患者を対
象に40mgを 1 日 1 回又は 1 日 2 回投与した二重盲検比較試
験において,40mg 1 日 2 回投与群では177例中16例
(9.0%)
に,40mg 1 日 1 回投与群では175例中17例(9.7%)に臨床検
査値異常を含む副作用が認められた.40mg 1 日 2 回投与群
での主な副作用は,頭痛 3 例
(1.7%)
,便秘 2 例
(1.1%)
等で
あった.二重盲検比較試験対象症例のうち,継続して40mg
1 日 2 回投与の長期投与試験の対象となった120例では,投
与開始後52週までに21例(17.5%)に臨床検査値異常を含む
副作用が認められた.主な副作用は浮腫 7 例(5.8%)
,貧血
2例
(1.7%)
,Al-P上昇 2 例
(1.7%)
等であった.また,40mg
1 日 1 回とカルシウム拮抗剤以外の降圧剤の併用投与で降
圧効果不十分な本態性高血圧症患者を対象に40mg 1 日 2 回
を他の降圧剤と併用投与した長期併用投与試験において,
投与開始後52週までに72例中21例(29.2%)に臨床検査値異
常を含む副作用が認められた.
主な副作用は頻脈 5 例
(6.9%)
,
歯肉肥厚 3 例(4.2%)等であった.(用法・用量の一部変更
承認時)
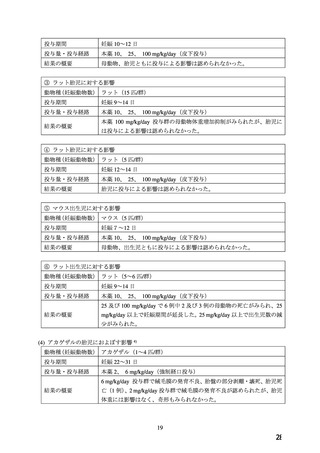
⑴重大な副作用(0.1%未満)
次のような副作用があらわれることがある.このような副
作用があらわれた場合には投与を中止し,適切な処置を
行うこと.
1)紅皮症(剝脱性皮膚炎)
2)無顆粒球症,血小板減少
3)肝機能障害,黄疸:AST
(GOT)
,ALT
(GPT)
,γ- GTP
の上昇等を伴う肝機能障害や黄疸があらわれることが
あるので,観察を十分に行い,異常が認められた場合
には投与を中止し,適切な処置を行うこと.
4)意識障害:他のニフェジピン製剤で,血圧低下に伴う一
過性の意識障害があらわれることがあるので,異常が認
められた場合には投与を中止し,
適切な処置を行うこと.
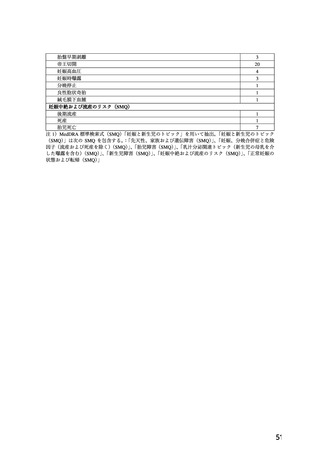
⑵その他の副作用
以下のような副作用があらわれた場合には,症状に応じ
適切な処置を行うこと.太字の副作用については投与を
中止すること.
0.1〜5%未満
0.1%未満
肝
臓 AST(GOT)上昇, 黄疸
ALT(GPT)上 昇,
γ-GTP上昇,Al-P
上昇,LDH上昇
腎
臓 BUN上昇
循
環
器 顔面 潮紅, 熱感, 胸 部 痛, 頻 脈, 頻 尿,
のぼせ,潮紅,動 発汗,悪寒
悸,血圧低下,起
立性低血圧,浮腫
(下肢,顔面等)
精神神経系 頭痛,めまい,
倦怠感
消
化
クレアチニン上昇
眠 気, 不 眠, 脱 力 感,
筋痙攣,四肢しびれ感,
異常感覚,振戦
器 悪心・嘔吐,便秘 上腹部痛,下痢,腹部
不快感,口渇,胸やけ,
食欲不振,鼓腸
0.1〜5%未満
過
敏
口
0.1%未満
症 発疹,瘙痒
光線過敏症,紫斑,血
管浮腫
腔
歯肉肥厚
代謝異常
高血糖
血
液
血小板減少,貧血,白
血球減少
呼
吸
器
呼吸困難,咳嗽,鼻出
血,鼻閉
そ
の
他
女性化乳房,視力異常
(霧視等)
,眼痛,筋肉
痛,関節痛,関節腫脹,
勃起不全
注1)
発現頻度は,ニフェジピン製剤の承認時までの臨床
試験
(ただし,本剤の用法・用量の一部変更承認時
の臨床試験を除く)及び使用成績調査の成績等に基
づく.
5.高齢者への投与
高齢者では一般に過度の降圧は好ましくないとされている
(脳梗塞等が起こるおそれがある)ので,高血圧症の高齢者
に使用する場合には低用量
(10mg/日)
から投与を開始するな
ど患者の状態を観察しながら慎重に投与すること.
なお,国内で実施された臨床試験において,65歳以上の高
齢者での副作用は206例中21例にみられた.75歳以上の高齢
者での使用経験は少ないが,投与された19例のうち 4 例に副
作用が認められた.
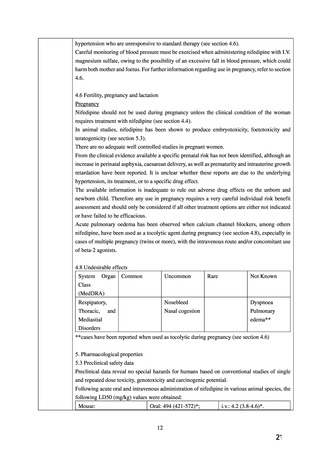
6.妊婦,産婦,授乳婦等への投与
⑴妊婦
(妊娠20週未満)又は妊娠している可能性のある婦人
には投与しないこと.
[動物実験において,催奇形性及び
胎児毒性が報告されている.
]
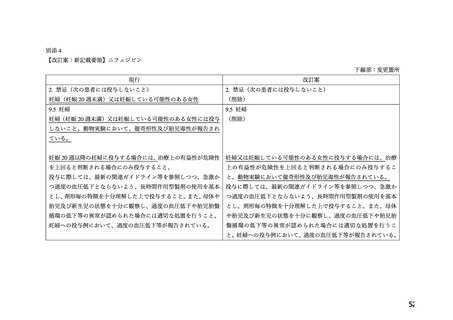
⑵妊娠20週以降の妊婦に投与する場合には,治療上の有益
性が危険性を上回ると判断される場合にのみ投与するこ
と.
[妊娠中の投与に関する安全性は確立していない.]
投与に際しては,最新の関連ガイドライン等を参照しつ
つ,急激かつ過度の血圧低下とならないよう,長時間作
用型製剤の使用を基本とし,剤形毎の特徴を十分理解し
た上で投与すること.また,母体や胎児及び新生児の状
態を十分に観察し,過度の血圧低下や胎児胎盤循環の低
下等の異常が認められた場合には適切な処置を行うこ
と.
[妊婦への投与例において,過度の血圧低下等が報
告されている.
]
⑶硫酸マグネシウム水和物の注射剤を併用する場合には,
血圧等を注意深くモニタリングすること.
[併用により,
過度の血圧低下や神経筋伝達遮断の増強があらわれるこ
とがある.
]
⑷授乳中の婦人に投与することを避け,やむを得ず投与す
る場合には授乳を中止させること.
[母乳中へ移行するこ
とが報告されている.
]
7.小児等への投与
低出生体重児,新生児,乳児,幼児又は小児に対する安全性
は確立していない.
8.過量投与
徴候と症状:過量投与に関する情報は少ないが,主要な臨
床症状として過度の血圧低下等が引き起こされる可能性が
ある.また肝機能障害があると症状が遷延することがある.
処 置:本剤の急性中毒に対しては,通常,胃洗浄若しく
は催吐,下剤及び活性炭の投与などの初期治療を行う.心
-3-
60
*4.副作用
承認時及び使用成績調査での調査症例5,745例中639例
(11.1
%)
に副作用
(臨床検査値の異常変動を含む)
が認められ,主
な副作用は頭痛・頭重感159例(2.8%),顔面潮紅・顔のほ
てり130例
(2.3%)
,動悸75例
(1.3%)
であった.
(再審査終了
時)
40mg 1 日 1 回で降圧効果不十分な本態性高血圧症患者を対
象に40mgを 1 日 1 回又は 1 日 2 回投与した二重盲検比較試
験において,40mg 1 日 2 回投与群では177例中16例
(9.0%)
に,40mg 1 日 1 回投与群では175例中17例(9.7%)に臨床検
査値異常を含む副作用が認められた.40mg 1 日 2 回投与群
での主な副作用は,頭痛 3 例
(1.7%)
,便秘 2 例
(1.1%)
等で
あった.二重盲検比較試験対象症例のうち,継続して40mg
1 日 2 回投与の長期投与試験の対象となった120例では,投
与開始後52週までに21例(17.5%)に臨床検査値異常を含む
副作用が認められた.主な副作用は浮腫 7 例(5.8%)
,貧血
2例
(1.7%)
,Al-P上昇 2 例
(1.7%)
等であった.また,40mg
1 日 1 回とカルシウム拮抗剤以外の降圧剤の併用投与で降
圧効果不十分な本態性高血圧症患者を対象に40mg 1 日 2 回
を他の降圧剤と併用投与した長期併用投与試験において,
投与開始後52週までに72例中21例(29.2%)に臨床検査値異
常を含む副作用が認められた.
主な副作用は頻脈 5 例
(6.9%)
,
歯肉肥厚 3 例(4.2%)等であった.(用法・用量の一部変更
承認時)
⑴重大な副作用(0.1%未満)
次のような副作用があらわれることがある.このような副
作用があらわれた場合には投与を中止し,適切な処置を
行うこと.
1)紅皮症(剝脱性皮膚炎)
2)無顆粒球症,血小板減少
3)肝機能障害,黄疸:AST
(GOT)
,ALT
(GPT)
,γ- GTP
の上昇等を伴う肝機能障害や黄疸があらわれることが
あるので,観察を十分に行い,異常が認められた場合
には投与を中止し,適切な処置を行うこと.
4)意識障害:他のニフェジピン製剤で,血圧低下に伴う一
過性の意識障害があらわれることがあるので,異常が認
められた場合には投与を中止し,
適切な処置を行うこと.
⑵その他の副作用
以下のような副作用があらわれた場合には,症状に応じ
適切な処置を行うこと.太字の副作用については投与を
中止すること.
0.1〜5%未満
0.1%未満
肝
臓 AST(GOT)上昇, 黄疸
ALT(GPT)上 昇,
γ-GTP上昇,Al-P
上昇,LDH上昇
腎
臓 BUN上昇
循
環
器 顔面 潮紅, 熱感, 胸 部 痛, 頻 脈, 頻 尿,
のぼせ,潮紅,動 発汗,悪寒
悸,血圧低下,起
立性低血圧,浮腫
(下肢,顔面等)
精神神経系 頭痛,めまい,
倦怠感
消
化
クレアチニン上昇
眠 気, 不 眠, 脱 力 感,
筋痙攣,四肢しびれ感,
異常感覚,振戦
器 悪心・嘔吐,便秘 上腹部痛,下痢,腹部
不快感,口渇,胸やけ,
食欲不振,鼓腸
0.1〜5%未満
過
敏
口
0.1%未満
症 発疹,瘙痒
光線過敏症,紫斑,血
管浮腫
腔
歯肉肥厚
代謝異常
高血糖
血
液
血小板減少,貧血,白
血球減少
呼
吸
器
呼吸困難,咳嗽,鼻出
血,鼻閉
そ
の
他
女性化乳房,視力異常
(霧視等)
,眼痛,筋肉
痛,関節痛,関節腫脹,
勃起不全
注1)
発現頻度は,ニフェジピン製剤の承認時までの臨床
試験
(ただし,本剤の用法・用量の一部変更承認時
の臨床試験を除く)及び使用成績調査の成績等に基
づく.
5.高齢者への投与
高齢者では一般に過度の降圧は好ましくないとされている
(脳梗塞等が起こるおそれがある)ので,高血圧症の高齢者
に使用する場合には低用量
(10mg/日)
から投与を開始するな
ど患者の状態を観察しながら慎重に投与すること.
なお,国内で実施された臨床試験において,65歳以上の高
齢者での副作用は206例中21例にみられた.75歳以上の高齢
者での使用経験は少ないが,投与された19例のうち 4 例に副
作用が認められた.
6.妊婦,産婦,授乳婦等への投与
⑴妊婦
(妊娠20週未満)又は妊娠している可能性のある婦人
には投与しないこと.
[動物実験において,催奇形性及び
胎児毒性が報告されている.
]
⑵妊娠20週以降の妊婦に投与する場合には,治療上の有益
性が危険性を上回ると判断される場合にのみ投与するこ
と.
[妊娠中の投与に関する安全性は確立していない.]
投与に際しては,最新の関連ガイドライン等を参照しつ
つ,急激かつ過度の血圧低下とならないよう,長時間作
用型製剤の使用を基本とし,剤形毎の特徴を十分理解し
た上で投与すること.また,母体や胎児及び新生児の状
態を十分に観察し,過度の血圧低下や胎児胎盤循環の低
下等の異常が認められた場合には適切な処置を行うこ
と.
[妊婦への投与例において,過度の血圧低下等が報
告されている.
]
⑶硫酸マグネシウム水和物の注射剤を併用する場合には,
血圧等を注意深くモニタリングすること.
[併用により,
過度の血圧低下や神経筋伝達遮断の増強があらわれるこ
とがある.
]
⑷授乳中の婦人に投与することを避け,やむを得ず投与す
る場合には授乳を中止させること.
[母乳中へ移行するこ
とが報告されている.
]
7.小児等への投与
低出生体重児,新生児,乳児,幼児又は小児に対する安全性
は確立していない.
8.過量投与
徴候と症状:過量投与に関する情報は少ないが,主要な臨
床症状として過度の血圧低下等が引き起こされる可能性が
ある.また肝機能障害があると症状が遷延することがある.
処 置:本剤の急性中毒に対しては,通常,胃洗浄若しく
は催吐,下剤及び活性炭の投与などの初期治療を行う.心
-3-
60