よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.3MB] (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
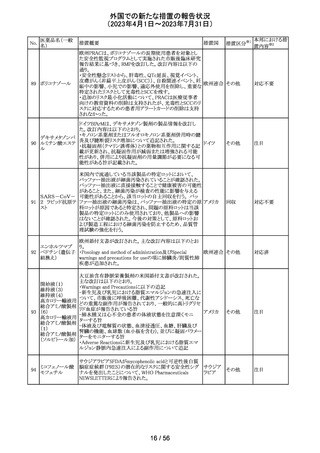
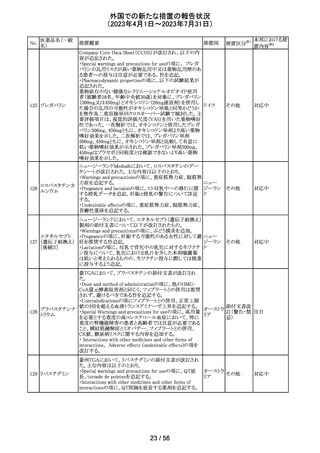
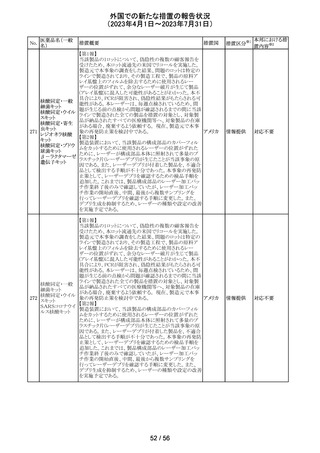
外国での新たな措置の報告状況
(2023年4月1日~2023年7月31日)
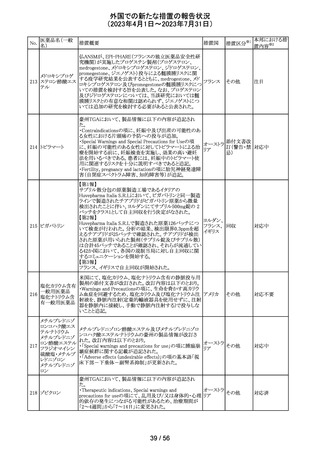
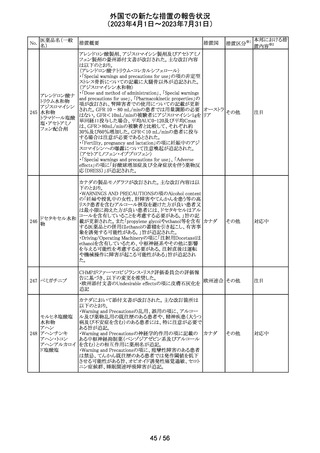
No.
医薬品名(一般
名)
措置概要
措置区分※1
本邦における措
置内容※2
その他
注目
オランダ その他
注目
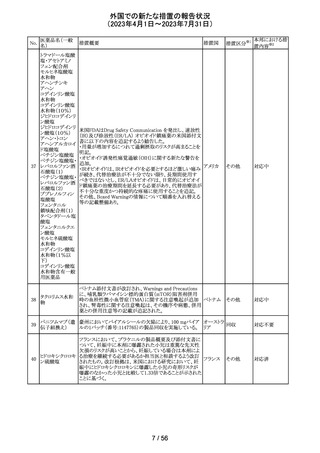
措置国
フェブキソスタットの米国添付文書が改訂された。改訂内容
は以下のとおり。
・Warnings and Precautionsの項の「Cardiovascular Death」
「Serious Skin Reactions」の記載が整備された。
・Warnings and Precautionsの項の「Hepatic Effects」の記
載が整備され、また、「フェブキソスタットによる肝損傷が確
認され、他の要因がない場合は、永久に中止すること。」が
52 フェブキソスタット
アメリカ
追記された。
・Drug Interactionsの項の「Xanthine Oxidase Substrate
Drugs」の記載の、アザチオプリンやメルカプトプリンを使用
中の患者ではフェブキソスタットは禁忌である旨の記載に、
フェブキソスタットとアザチオプリンの薬物相互作用試験の
結果、6-メルカプトプリンの曝露が増加した旨が追記され
た。
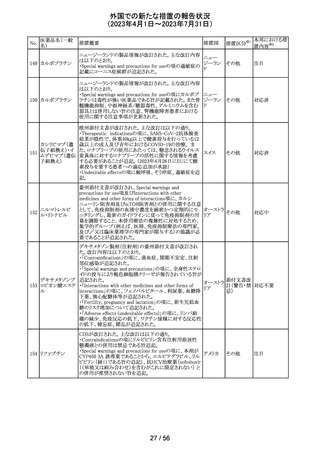
53
ギルテリチニブフ
マル酸塩
オランダにおいて、ギルテリチニブを使用するHOVON 156
AML/AMLSG 28-18試験*の治験実施計画書が改訂され
た。主な改訂内容は以下のとおり。
・感染症の予防に関する注意喚起並びに可逆性後白質脳
症症候群、膵炎及び分化症候群が発現した場合の本剤の
用量調節基準について追記された。
*高強度化学療法に適格なFLT3変異を有する急性骨髄性
白血病又は芽球増加を伴う骨髄異形成症候群2と新規診
断された患者を対象に、寛解導入療法及び地固め療法と
のギルテリチニブもしくはMidostaurinの併用並びにその後
1年の維持療法を行う多施設共同非盲検無作為化第III相
試験
54 プロポフォール
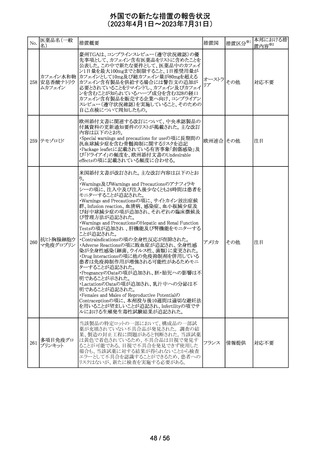
【第1報】
欧州PRACは、MAHにメディケーションエラーに関する情報
収集を依頼していた。今般、外装/直接包装に「1人の患者
に1回使用、複数回使用で敗血症リスク、開封後はすぐに
使用すること」と記載するよう勧告された。
【第2報】
欧州連
独BfArMは、欧州PRACの勧告を承認し、プロポフォール含 合、
有医薬品の包装上に、以下の警告が追加されるべきである ドイツ
と公表した。
・患者1例に対し単回使用すること。複数回使用により敗血
症のリスクがある。
・開封後ただちに使用すること。
本件に関して、Rote-Hand-Briefが掲載された。
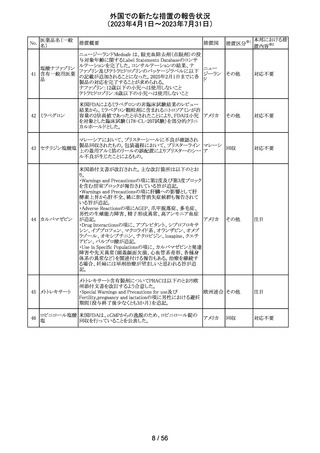
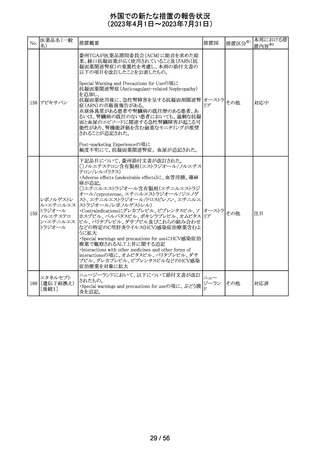
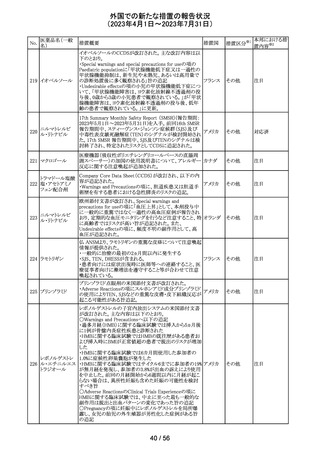
55 トピラマート
ニュージーランド Medsafeより、Janssenがデータシートを改
訂し、Dear Healthcare Professional Letterを医療専門家向
ニュー
けに発行した旨、情報提供された。内容は以下のとおり。
ジーラン 情報提供
・子宮内でトピラマートに曝露された小児の神経発達障害
ド
(自閉症スペクトラム障害及び知的能力障害)、先天性欠
損リスクについての注意喚起。
その他
注目
対応中
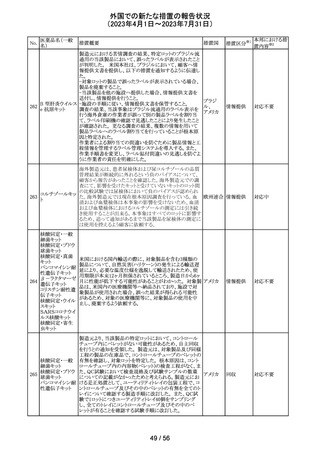
南アフリカ規制当局より、パラセタモール(アセトアミノフェ
ン)含有医薬品の製品情報に以下を追記するよう勧告され
たもの。
・副作用及び市販後の使用経験に固定薬疹(FDE)及び薬
剤性過敏症症候群(DIHS)のリスクを追加。
アセトアミノフェン
・使用上の注意の項に、皮膚有害反応のリスクに関する一 南アフリ
56 含有一般用医薬
般的な警告を追加。
カ
品
改訂の契機はファーマコビジランス委員会(PRAC)でパラ
セタモール含有医薬品のFDE及びDIHSのリスクに関して
審議されたことによる。なお、DIHSはPMDAの安全性デー
タベースで報告された3例(うち1例は薬剤と事象の因果関
係が合理的に可能)に基づき検討された。
その他
対応済
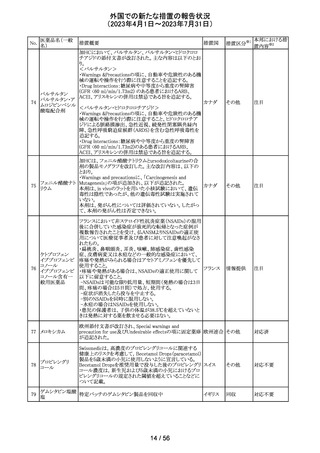
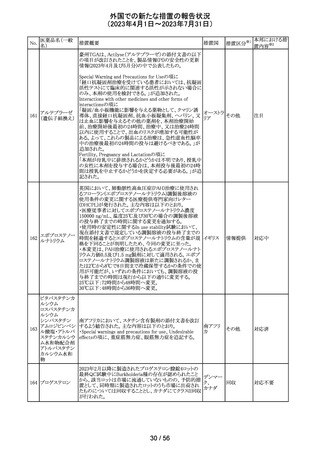
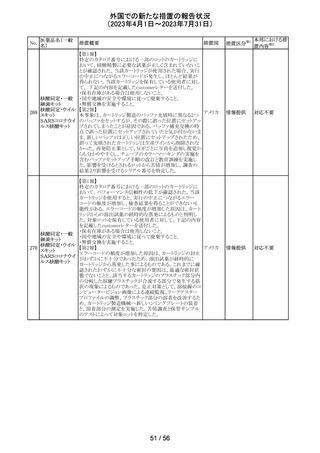
To Whom It May Concernレターが発出され、未承認の硝
ベバシズマブ(遺
子体内使用において眼の有害事象により視力障碍が生じ スイス
伝子組換え)
る可能性がある旨が注意喚起された。
情報提供
対応済
57
10 / 56
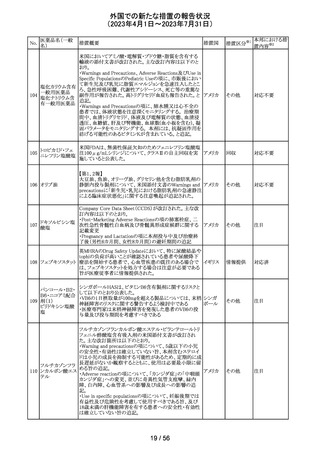
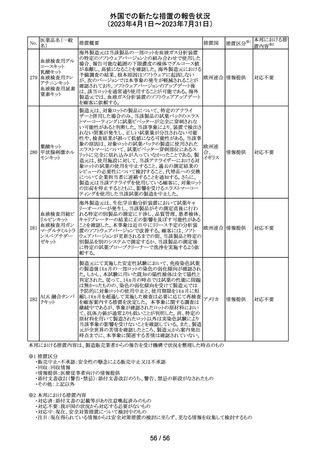
(2023年4月1日~2023年7月31日)
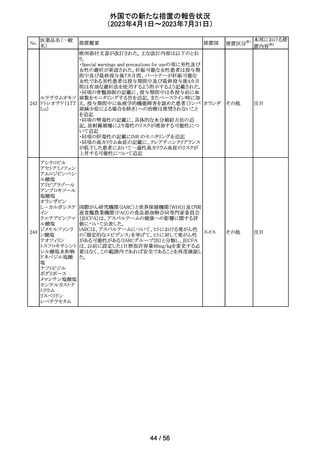
No.
医薬品名(一般
名)
措置概要
措置区分※1
本邦における措
置内容※2
その他
注目
オランダ その他
注目
措置国
フェブキソスタットの米国添付文書が改訂された。改訂内容
は以下のとおり。
・Warnings and Precautionsの項の「Cardiovascular Death」
「Serious Skin Reactions」の記載が整備された。
・Warnings and Precautionsの項の「Hepatic Effects」の記
載が整備され、また、「フェブキソスタットによる肝損傷が確
認され、他の要因がない場合は、永久に中止すること。」が
52 フェブキソスタット
アメリカ
追記された。
・Drug Interactionsの項の「Xanthine Oxidase Substrate
Drugs」の記載の、アザチオプリンやメルカプトプリンを使用
中の患者ではフェブキソスタットは禁忌である旨の記載に、
フェブキソスタットとアザチオプリンの薬物相互作用試験の
結果、6-メルカプトプリンの曝露が増加した旨が追記され
た。
53
ギルテリチニブフ
マル酸塩
オランダにおいて、ギルテリチニブを使用するHOVON 156
AML/AMLSG 28-18試験*の治験実施計画書が改訂され
た。主な改訂内容は以下のとおり。
・感染症の予防に関する注意喚起並びに可逆性後白質脳
症症候群、膵炎及び分化症候群が発現した場合の本剤の
用量調節基準について追記された。
*高強度化学療法に適格なFLT3変異を有する急性骨髄性
白血病又は芽球増加を伴う骨髄異形成症候群2と新規診
断された患者を対象に、寛解導入療法及び地固め療法と
のギルテリチニブもしくはMidostaurinの併用並びにその後
1年の維持療法を行う多施設共同非盲検無作為化第III相
試験
54 プロポフォール
【第1報】
欧州PRACは、MAHにメディケーションエラーに関する情報
収集を依頼していた。今般、外装/直接包装に「1人の患者
に1回使用、複数回使用で敗血症リスク、開封後はすぐに
使用すること」と記載するよう勧告された。
【第2報】
欧州連
独BfArMは、欧州PRACの勧告を承認し、プロポフォール含 合、
有医薬品の包装上に、以下の警告が追加されるべきである ドイツ
と公表した。
・患者1例に対し単回使用すること。複数回使用により敗血
症のリスクがある。
・開封後ただちに使用すること。
本件に関して、Rote-Hand-Briefが掲載された。
55 トピラマート
ニュージーランド Medsafeより、Janssenがデータシートを改
訂し、Dear Healthcare Professional Letterを医療専門家向
ニュー
けに発行した旨、情報提供された。内容は以下のとおり。
ジーラン 情報提供
・子宮内でトピラマートに曝露された小児の神経発達障害
ド
(自閉症スペクトラム障害及び知的能力障害)、先天性欠
損リスクについての注意喚起。
その他
注目
対応中
南アフリカ規制当局より、パラセタモール(アセトアミノフェ
ン)含有医薬品の製品情報に以下を追記するよう勧告され
たもの。
・副作用及び市販後の使用経験に固定薬疹(FDE)及び薬
剤性過敏症症候群(DIHS)のリスクを追加。
アセトアミノフェン
・使用上の注意の項に、皮膚有害反応のリスクに関する一 南アフリ
56 含有一般用医薬
般的な警告を追加。
カ
品
改訂の契機はファーマコビジランス委員会(PRAC)でパラ
セタモール含有医薬品のFDE及びDIHSのリスクに関して
審議されたことによる。なお、DIHSはPMDAの安全性デー
タベースで報告された3例(うち1例は薬剤と事象の因果関
係が合理的に可能)に基づき検討された。
その他
対応済
To Whom It May Concernレターが発出され、未承認の硝
ベバシズマブ(遺
子体内使用において眼の有害事象により視力障碍が生じ スイス
伝子組換え)
る可能性がある旨が注意喚起された。
情報提供
対応済
57
10 / 56