よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.3MB] (50 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
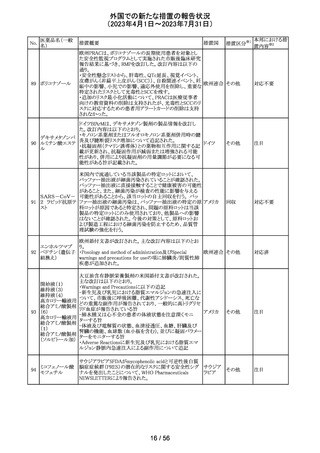
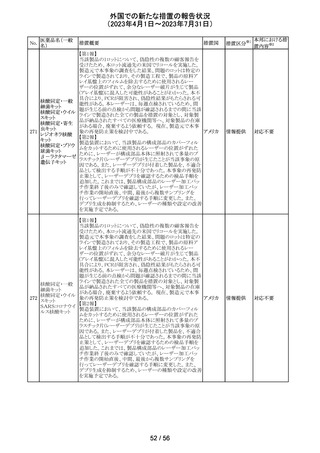
外国での新たな措置の報告状況
(2023年4月1日~2023年7月31日)
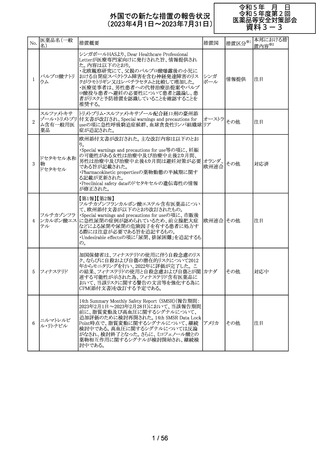
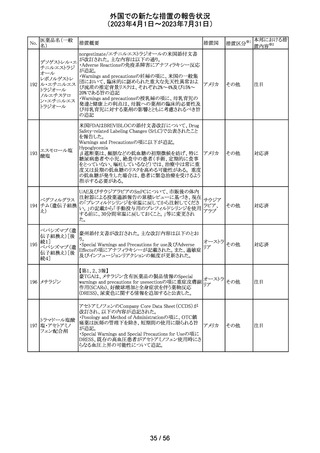
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
本邦における措
置内容※2
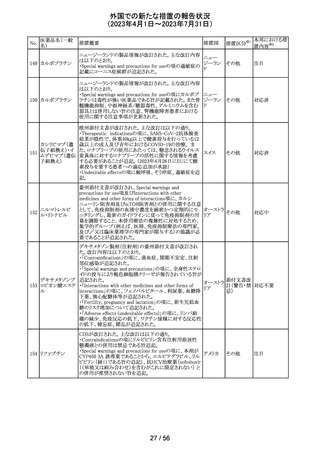
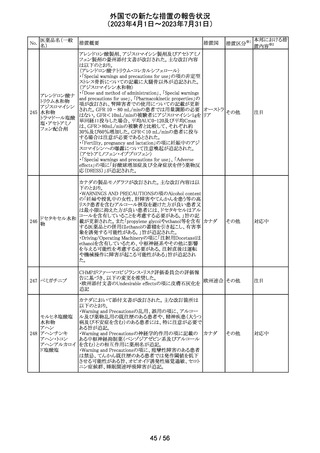
当該製品で患者検体および精度管理試料を測定した場合
に、一部の試薬で測定結果が偽高値または偽低値となる
可能性があることが製造元で確認された。本事象は精度管
アメリカ、
理試料を測定することで発見することができるが、気が付か
イギリス、
ずに患者検体の測定に使用された場合、誤った測定値が
カナダ、
グリコヘモグロビ 臨床に報告される可能性がある。製造元では原因究明の
266
フランス、 情報提供
ンA1cキット
調査を継続しているが、現在のところ原因の特定に至って
ドイツ、
いない。また、事象が確認されたロット以外の使用期限内
オーストラ
の全ロットの調査が完了するまでの間は、本製品を使用す
リア
る全ての顧客に対して、本事象の説明と対処方法について
情報提供を実施した。なお、本事象回避のための対処に
ついては、今後製造されるロットにも適用される。
対応中
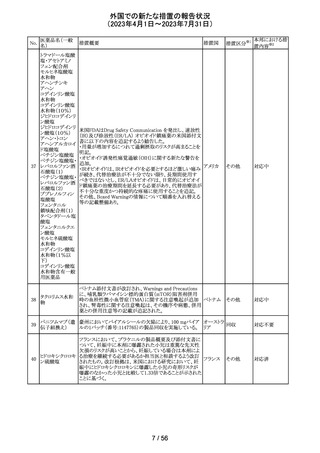
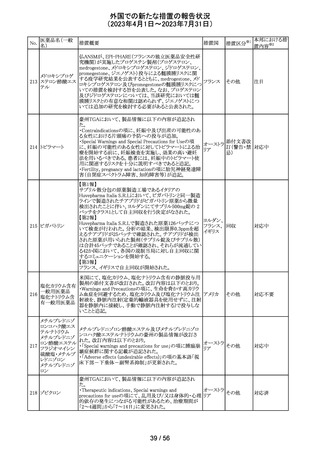
製造元における分注工程時の誤設定により、特定ロットの
対象製品で一部の構成試薬が添付文書に記載された容
量より僅かに少ないことが確認された。試薬容量が僅かに
少ないことによる測定性能への影響はないことが確認され
ている。 製造元は、2製品の本問題について顧客へ文書
により情報提供を行うことを決定した。海外製造所における
調査の結果、当該事象は、分注量の設定を変更した際に
作業者の人為的ミスにより製品情報シートに用いる質量(g)
アメリカ、
血液検査用甲状 と体積(mL)の単位表記を誤ったことが原因と特定された。こ
欧州連
腺ペルオキシ
れにより、溶液の密度によっては試薬充填装置の分注量が
合、
ダーゼ抗体キット 僅かに減少した。また、設計変更で承認されたマスター情
267
イギリス、 情報提供
サイトメガロウイル 報の様式に単位表記がなかったことが、マスター情報と照
カナダ、
ス免疫グロブリン 合して製品情報シートの検証を行った際に表記単位の誤り
オーストラ
M キット
を検知できなかった一因と推察された。海外製造所で特定
リア
期間に分注量の設定を変更した製品の設定値を調査した
結果、設定値に誤りがあった製品ロットのうち、出荷された3
製品が措置の対象に特定された。当該製品の分注量の設
定値を修正し、次ロットの製造から正しい設定値で分注が
行われている。また、是正措置としてマスター情報の様式
に単位表記を追加した。さらに、分注量の設定値の変更
は、上長が該当する設計変更に基づき検証を行う手順に
変更した。
対応不要
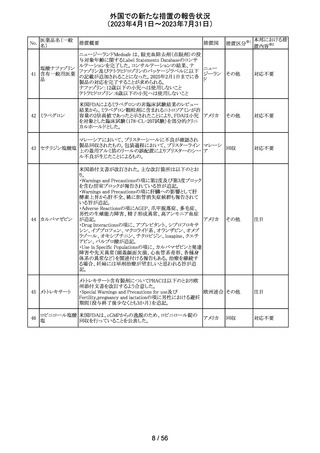
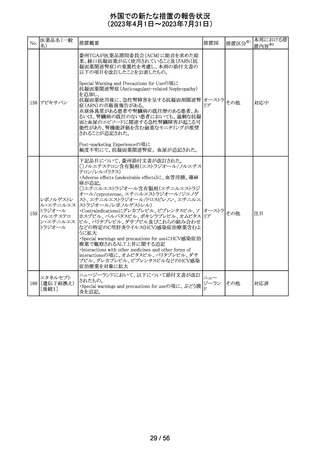
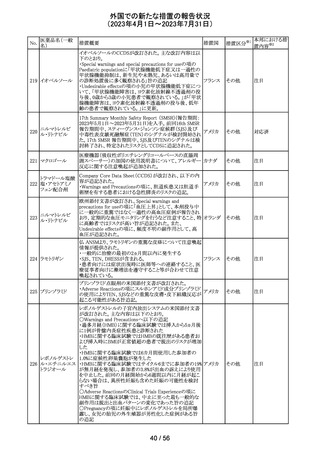
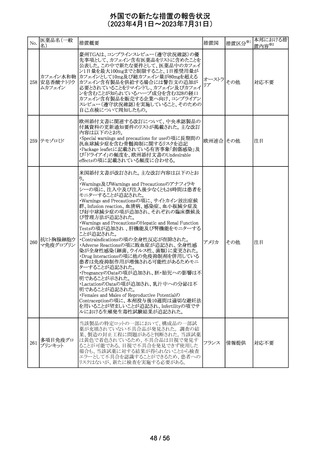
【第1報】
特定のカタログ番号における一部のロットのカートリッジに
ついて、一部の反応チャンバーにてPCRプライマーとプ
ローブが混在していることが確認された。当該カートリッジを
サンプルテストに使用した場合、誤ったテスト結果が発生す
る可能性がある。 影響を受けるシリアル番号のものを保有
している使用者に対して、下記の内容を記載したcustomer
レターを送付した。
核酸同定・一般 ・保有在庫がある場合は使用しないこと。
細菌キット
・国や地域の安全や環境に従って廃棄すること。
核酸同定・ウイル ・無償交換を実施すること。
268
アメリカ
スキット
・当該ロットを既に使用している場合は、検査結果を確認す
SARSコロナウイ ること。
ルス核酸キット
【第2報】
本事象は、製造工程で2セットのチューブが並行して使用さ
れており、これら2セットのうちの1セットでのみチューブが製
造装置内で誤った位置にセットされ、誤った反応チャン
バーに充填されたことが原因である。再発防止策として、
SOPごとに写真を追加し視覚からも分かりやすくし、カメラシ
ステムの実装による監視体制の強化を行い、教育訓練を実
施した。配置違いでセットした装置で製造した製品のシリア
ルを措置の対象とした。
対応不要
50 / 56
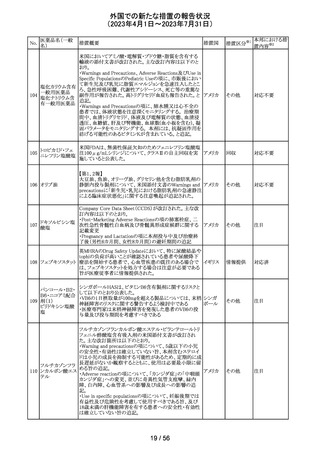
情報提供
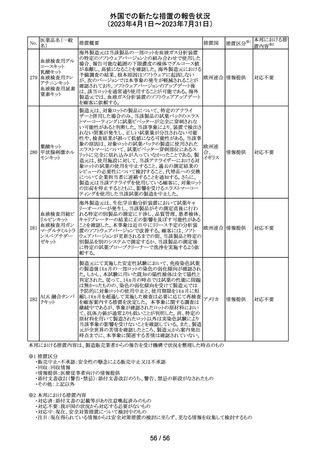
(2023年4月1日~2023年7月31日)
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
本邦における措
置内容※2
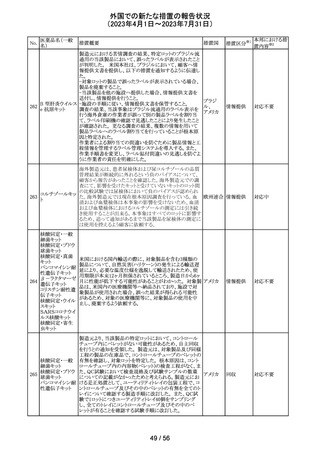
当該製品で患者検体および精度管理試料を測定した場合
に、一部の試薬で測定結果が偽高値または偽低値となる
可能性があることが製造元で確認された。本事象は精度管
アメリカ、
理試料を測定することで発見することができるが、気が付か
イギリス、
ずに患者検体の測定に使用された場合、誤った測定値が
カナダ、
グリコヘモグロビ 臨床に報告される可能性がある。製造元では原因究明の
266
フランス、 情報提供
ンA1cキット
調査を継続しているが、現在のところ原因の特定に至って
ドイツ、
いない。また、事象が確認されたロット以外の使用期限内
オーストラ
の全ロットの調査が完了するまでの間は、本製品を使用す
リア
る全ての顧客に対して、本事象の説明と対処方法について
情報提供を実施した。なお、本事象回避のための対処に
ついては、今後製造されるロットにも適用される。
対応中
製造元における分注工程時の誤設定により、特定ロットの
対象製品で一部の構成試薬が添付文書に記載された容
量より僅かに少ないことが確認された。試薬容量が僅かに
少ないことによる測定性能への影響はないことが確認され
ている。 製造元は、2製品の本問題について顧客へ文書
により情報提供を行うことを決定した。海外製造所における
調査の結果、当該事象は、分注量の設定を変更した際に
作業者の人為的ミスにより製品情報シートに用いる質量(g)
アメリカ、
血液検査用甲状 と体積(mL)の単位表記を誤ったことが原因と特定された。こ
欧州連
腺ペルオキシ
れにより、溶液の密度によっては試薬充填装置の分注量が
合、
ダーゼ抗体キット 僅かに減少した。また、設計変更で承認されたマスター情
267
イギリス、 情報提供
サイトメガロウイル 報の様式に単位表記がなかったことが、マスター情報と照
カナダ、
ス免疫グロブリン 合して製品情報シートの検証を行った際に表記単位の誤り
オーストラ
M キット
を検知できなかった一因と推察された。海外製造所で特定
リア
期間に分注量の設定を変更した製品の設定値を調査した
結果、設定値に誤りがあった製品ロットのうち、出荷された3
製品が措置の対象に特定された。当該製品の分注量の設
定値を修正し、次ロットの製造から正しい設定値で分注が
行われている。また、是正措置としてマスター情報の様式
に単位表記を追加した。さらに、分注量の設定値の変更
は、上長が該当する設計変更に基づき検証を行う手順に
変更した。
対応不要
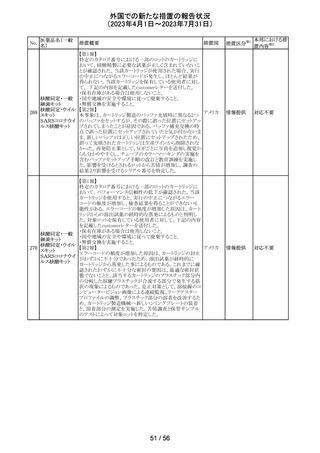
【第1報】
特定のカタログ番号における一部のロットのカートリッジに
ついて、一部の反応チャンバーにてPCRプライマーとプ
ローブが混在していることが確認された。当該カートリッジを
サンプルテストに使用した場合、誤ったテスト結果が発生す
る可能性がある。 影響を受けるシリアル番号のものを保有
している使用者に対して、下記の内容を記載したcustomer
レターを送付した。
核酸同定・一般 ・保有在庫がある場合は使用しないこと。
細菌キット
・国や地域の安全や環境に従って廃棄すること。
核酸同定・ウイル ・無償交換を実施すること。
268
アメリカ
スキット
・当該ロットを既に使用している場合は、検査結果を確認す
SARSコロナウイ ること。
ルス核酸キット
【第2報】
本事象は、製造工程で2セットのチューブが並行して使用さ
れており、これら2セットのうちの1セットでのみチューブが製
造装置内で誤った位置にセットされ、誤った反応チャン
バーに充填されたことが原因である。再発防止策として、
SOPごとに写真を追加し視覚からも分かりやすくし、カメラシ
ステムの実装による監視体制の強化を行い、教育訓練を実
施した。配置違いでセットした装置で製造した製品のシリア
ルを措置の対象とした。
対応不要
50 / 56
情報提供